ソース:ジョセフ・C・マスカット、ヴィタリー・L・レイズ、クレイグ・J・ゲルゲン、ウェルドン・スクール・オブ・バイオメディカル・エンジニアリング、パデュー大学、ウェスト・ラファイエット、インディアナ州
このビデオの目的は、患者または動物特有の血管系に基づく計算流体動的(CFD)シミュレーションの最近の進歩を記述することです。ここでは、被験者ベースの容器セグメンテーションを作成し、オープンソースと商用ツールを組み合わせて、フローモデル内で高分解能数値解を決定した。多くの研究は、血管内の出血力学的状態がアテローム性動脈硬化症、動脈瘤、および他の末梢動脈疾患の発症および進行に影響を与えることを実証している。それに加えて、ルミナル圧、壁せん断応力(WSS)、および粒子滞留時間(PRT)の直接測定は、生体内で取得することが困難である。
CFDは、そのような変数を非侵襲的に評価することを可能にする。さらに、CFDは手術後の流れの状態に関するよりよい先見性を医師に提供する外科技術をシミュレートするために使用される。磁気共鳴画像(MRI)、磁気共鳴血管造影(MRA)、飛行時間(TOF-MRA)またはコントラスト増強MRA(CE-MRA)と位相コントラスト(PC-MRI)の2つの方法により、船舶の形状と時間分解3D速度場を得ることができます。それぞれ。TOF-MRAは、画像化されたボリュームに適用される繰り返しRFパルスによる静的組織からの信号の抑制に基づいている。信号は、流れる血液と共に体積に移動する不飽和スピンから得られる。CE-MRAは、ガドリニウムなどの造影剤を使用して信号を増加させるため、複雑な再循環流を有する血管をイメージングするためのより良い技術です。
これとは別に、PC-MRIはバイポーラ勾配を利用して流体の速度に比例する位相シフトを生成し、時間分解速度分布を提供します。PC-MRIは血流速度を提供することができるが、この方法の精度は限られた時空間分解能および速度のダイナミックレンジの影響を受ける。CFDは優れた解像度を提供し、高速ジェットから疾患血管で観察される遅い再循環渦まで速度の範囲を評価することができます。したがって、CFDの信頼性はモデリングの仮定に依存するが、それは診断および治療を導くことができる患者特有の流れ分野の高品質、包括的な描写のための可能性を開く。
Biomedical Engineering
ソース:ハンナ・L・セブル1, アービン・H・ソエプリアトナ1, ジョン・J・ボイル2 ,クレイグ・J・ゲルゲン1
1インディアナ州パデュー大学、ウェストラファイエット大学ウェルドンバイオメディカルエンジニアリングスクール
2ワシントン大学セントルイス校機械工学・材料科学(ミズーリ州セントルイス)
血管、皮膚、腱、その他の器官などの軟部組織の機械的挙動は、エラスチンとコラーゲンの組成の影響を強く受け、弾力性と強度を提供します。これらのタンパク質の繊維配向は、軟部組織の種類に依存し、単一の好ましい方向から複雑なメッシュネットワークまでさまたえ、疾患組織で変化する可能性があります。したがって、軟部組織は、多くの場合、細胞および器官レベルで異性体的に動作し、三次元特性評価の必要性を作成する。複雑な生体組織または構造内の歪み場を確実に推定する方法を開発することは、疾患を機械的に特徴付け、理解するために重要である。ひずみは、軟部組織が時間の経過とともに相対的に変形する様子を表し、様々な推定を通じて数学的に記述することができる。
時間の経過とむいて画像データを取得すると、変形やひずみを推定できます。しかし、すべての医療画像モダリティはある程度のノイズを含み、生体内株を正確に推定する難易度を高めます。ここで説明する手法では、直接変形推定(DDE)法を使用して、体積画像データから空間的に変化する 3D ひずみフィールドを計算することで、これらの問題をうまく克服します。
電流ひずみ推定方法には、デジタル画像相関(DIC)およびデジタル体積相関が含まれる。残念ながら、DICは2D平面からのひずみを正確に推定することしかでき、この方法の適用を厳しく制限します。DIC などの 2D 法は有用ですが、3D 変形を受ける領域での歪みを定量化するのが困難です。これは、面外モーションによって変形エラーが発生するためです。デジタルボリューム相関は、初期ボリュームデータを領域に分割し、変形ボリュームの最も類似した領域を検出し、面外誤差を低減する、より適用可能な方法です。しかし、この方法はノイズに敏感であることを証明し、材料の機械的特性に関する仮定を必要とします。
ここで実証した技術は、DDE法を用いてこれらの問題を排除し、医療画像データの解析に非常に有用である。さらに、それは高いか局所的なひずみを強くする。ここでは、ゲート、体積4D超音波データの取得、分析可能な形式への変換、および3D変形とそれに対応するグリーンラグランジュ株を推定するためのカスタムMatlabコードの使用について説明します。グリーンラグランジュひずみテンソルは、変位の最小二乗フィット(LSF)からFを計算することができるため、多くの3Dひずみ推定法で実装されています。次の式は、グリーン ラグランジュひずみテンソルEを表し、FとIはそれぞれ変形勾配と 2 次 ID テンソルを表します。
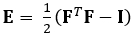 (1)
(1)
Biomedical Engineering
出典:フレデリック・W・ダーメンとクレイグ・J・ガーゲン、ウェルドン生物医工学部、パデュー大学、ウェストラファイエット、インディアナ州
このビデオでは、高視野、生理学的モニタリングを有する小さなボア磁気共鳴画像(MRI)が、マウス心血管系のゲートシネループを獲得することが実証されている。この手順は、左心室機能を評価し、血管ネットワークを可視化し、呼吸による臓器の動きを定量化するための基礎を提供する。同等の小動物心血管イメージングモダリティには、高周波超音波およびマイクロコンピュータ断層撮影(CT)が含まれます。ただし、各モダリティは、考慮する必要があるトレードオフに関連付けられています。超音波は高い空間的および時間的な決断を提供するが、イメージングアーティファクトは一般的である。例えば、緻密な組織(すなわち、胸骨および肋骨)は、イメージング浸透深さを制限することができ、および気体と液体との界面における高周エコー信号(すなわち、肺を取り巻く胸膜)は、近くの組織においてコントラストをぼかすことができる。対照的にマイクロCTは、多くの面内アーティファクトに苦しんではいませんが、時間分解能が低く、柔らかい組織のコントラストが制限されています。さらに、マイクロCTはX線放射を使用し、多くの場合、放射線損傷や腎損傷を含む高用量で副作用を引き起こすことが知られている血管系を可視化するために造影剤の使用を必要とします。心血管MRIは、電離放射線の必要性を否定し、造影剤なしで画像を画像化する能力をユーザーに提供することによって、これらの技術間の素晴らしい妥協を提供します(ただし、造影剤はMRIにしばしば使用されます)。
このデータは、呼吸中の心臓サイクルおよび呼吸高原のRピークからゲートオフされたトリガ高速低角度SHot(FLASH)MRI配列で取得された。これらの生理学的事象は、皮下電極および腹部に対して固定された感圧枕を通して監視された。マウスが適切に温かされたことを確認するために、直腸温度プローブを挿入し、MRI安全加熱ファンの出力を制御するために使用しました。動物がMRIスキャナーの穴に挿入され、位置決めを確認するためにナビゲーションシーケンスが実行されると、ゲートFLASHイメージングプレーンが処方され、データが取得されました。全体的に、高磁場MRIは、小動物疾患モデルの研究のための柔らかい組織のコントラストを提供することができる強力な研究ツールです。
Biomedical Engineering
出典:アービン・H・ソエプリアートナ1、ケルシー・A・ブレンス2、クレイグ・J・ゲーゲン1
1インディアナ州パデュー大学、ウェストラファイエット大学ウェルドンバイオメディカルエンジニアリングスクール
2インディアナ州ウェストラファイエット校パデュー大学生化学科
近赤外蛍光(NIRF)イメージングは、蛍光プローブを利用して組織の複雑な生体分子アセンブリを可視化するエキサイティングな光学技術です。NIRFイメージングは、疾患の非侵襲的イメージングのための従来のイメージング方法に対して多くの利点を有する。単一光子放出コンピュータ断層撮影(SPECT)や陽電子放射断層撮影(PET)とは異なり、NIRFイメージングは高速で高スループットであり、電離放射線を伴いません。さらに、工学的標的特異的および活性化可能な蛍光プローブの最近の発展は、NIRFに高い特異性と感度を提供し、癌および心血管疾患の研究において魅力的なモダリティとなっています。提示された手順は、NIRFイメージングの背後にある原理と、様々な疾患を研究するために、小動物の生体内およびex vivo実験を行う方法を実証するように設計されています。ここに示す具体例は、マトリックスメタロプロテイナーゼ-2(MMP2)の活性化可能な蛍光プローブを用いて、腹部大動脈瘤(AAA)の2つの異なるげっ歯類モデルにおける取り込みを研究する。
Biomedical Engineering
出典:ガーニート・S・サンガとクレイグ・J・ガーゲン, ウェルドン生物医工学研究科, パデュー大学, ウェストラファイエット, インディアナ州
光音響断層撮影(PAT)は、光発生音波を利用して組織から組成情報を得る新たな生物医学的イメージングモダリティです。PATは、血液および脂質成分を画像化するために使用することができ、これは、心血管および腫瘍イメージングを含む多種多様な用途に有用である。現在使用されているイメージング技術には、研究者や医師との使用を制限する固有の制限があります。例えば、長い取得時間、高コスト、有害なコントラストの使用、および高侵襲性への最小限の要因はすべて、実験室および診療所における様々なモダリティの使用を制限する要因である。現在、PATに匹敵する唯一のイメージング技術は、新たな光学技術です。しかし、これらはまた、浸透の限られた深さと外因性造影剤の必要性などの欠点を有する。PAT は、迅速で非侵襲的なラベルのない方法で意味のある情報を提供します。超音波と組み合わせると、PATは組織から構造的、馬力学的、および組成情報を得るために使用することができ、それによって現在使用されているイメージング技術を補完する。PATの利点は前臨床および臨床環境の両方で影響を与える機能を示す。
Biomedical Engineering
ソース:アリシア・G・バーマン、ジェームズ・A・シェーバー、クレイグ・J・ガーゲン、インディアナ州パデュー大学、パーデュー大学ウェルドン・スクール・オブ・バイオメディカル・エンジニアリング
ここでは、マウスを用いた単光子放出コンピュータ断層撮影/コンピュータ断層撮影(SPECT/CT)イメージングの基礎を示します。この技術では、マウスに放射性核種を注入し、動物が全身に分布した後にイメージングを行い、生成された画像を再構築して体積データセットを作成します。これは、病気の診断を改善し、その進行を監視するために解剖学、生理学、および代謝に関する情報を提供することができます。
収集されたデータに関しては、SPECT/CTは陽電子放射断層撮影法(PET)/CTと同様の情報を提供する。しかし、PETは反対方向に放出される2つのガンマフォトンの検出を必要とするため、これら2つの技術の基本原理は根本的に異なります。対照的に、SPECTイメージングはガンマカメラを介して直接放射線を測定します。その結果、SPECTイメージングはPETよりも低い空間分解能を有する。しかし、SPECT放射性同位元素がより容易に入手可能であるため、それはまた安価である。SPECT/CTイメージングは、非侵襲的な代謝と解剖学的情報の両方を提供し、多種多様なアプリケーションに役立ちます。
Biomedical Engineering
ソース:アメリア・R・アデルスパーガー、エヴァン・H・フィリップス、クレイグ・J・ゲルゲン、インディアナ州パデュー大学、パデュー大学ウェルドン・スクール・オブ・バイオメディカル・エンジニアリング
高周波超音波システムは、高解像度の画像を取得するために使用されます。ここでは、マウスおよびラットに見られる小さな脈動性動脈および静脈の形態および運動力学を画像化するために、最先端のシステムの使用が実証される。超音波は、人間だけでなく、大小動物の血管の非侵襲的な評価のための比較的安価で、ポータブルで、汎用性の高い方法です。これらは、コンピュータ断層撮影(CT)、磁気共鳴画像(MRI)、近赤外蛍光断層撮影(NIRF)などの他の技術と比較してUltraoundが提供するいくつかの重要な利点です。CTは電離放射線を必要とし、MRIは非常に高価であり、一部のシナリオでは実用的でもありません。一方、NIRFは、蛍光造影剤を励起するために必要な光の浸透深さによって制限される。
超音波は、イメージングの深さの面で制限があります。ただし、これは分解能を犠牲にし、低周波トランスデューサを使用することで克服できます。腹部ガスと過剰な体重は、大幅に画質を低下させることができます。最初のケースでは、音波の伝播は限られており、後者の場合、それらは脂肪および結合組織などの組織の上にあるによって減衰される。その結果、コントラストやかすかなコントラストは認められない。最後に、超音波は、解剖学に精通し、画像化アーティファクトや音響干渉の出現などの問題を回避することができるようにソノグラファーを必要とする、高度にユーザーに依存する技術です。
Biomedical Engineering
ソース:ハムナ・J・クレシとクレイグ・J・ガーゲン,インディアナ州パデュー大学,パデュー大学,ウェルドン・スクール・オブ・バイオメディカル・エンジニアリング
ここでは、ヒトとげっ歯類の非侵襲的な血圧測定技術の主な類似点と相違点を取り上げ、血圧を支配する工学原理を検討する。収縮期および拡張期圧を獲得するために現在のカフ技術を支配する原則についても議論する。
モバイルデバイスと接続する市販のカフスは、一般的にコンパクトでポータブルなので、ほぼすべての場所で測定を行うことができる。非侵襲的な、携帯用血圧カフは、高血圧および血圧の変化の注意深い監視および早期発見を必要とする他の心血管の問題を有する患者にとって特に有用である。
同様に、非侵襲的な血圧測定システムはげっ歯類のためにまた利用できる。この技術は実験室の設定で使用され、研究全体を通して動物の健康を監視するために有用である。放射線テレメトリはげっ歯類の血圧測定のゴールドスタンダードですが、この技術は侵襲的であり、誤って行われると動物の死亡率につながる可能性があります。従って非侵襲的な方法は装置の注入を必要とせずに貴重なデータを提供できるので動物の測定のためによい。市販のシステムは、臨床環境外のヒトで血圧を測定する方法を実証するために使用されます。この技術は、患者がこれらの測定を行うたびに診療所を訪問することなく、定期的に自分の血圧を監視することができます。
ここで説明する方法は、圧力センサと閉塞カフを使用してげっ歯類の尾部を通る血流を利用する。ヒト用の移動式血圧カフとげっ歯類用の非侵襲的な尾カフ法の両方が、同様の血行力学的原理を利用して、臨床医、研究者、および患者。
Biomedical Engineering
