20.10:
Los Colores y el Magnetismo
20.10:
Los Colores y el Magnetismo
El color en los complejos de coordinación
Cuando los átomos o moléculas absorben la luz a la frecuencia adecuada, sus electrones se excitan a orbitales de mayor energía. Para muchos átomos y moléculas del grupo principal, los fotones absorbidos están en el rango ultravioleta del espectro electromagnético, que no puede ser detectado por el ojo humano. Para los compuestos de coordinación, la diferencia de energía entre los orbitales d a menudo permite que los fotones en el rango visible sean absorbidos y emitidos, lo cual es visto como colores por el ojo humano.
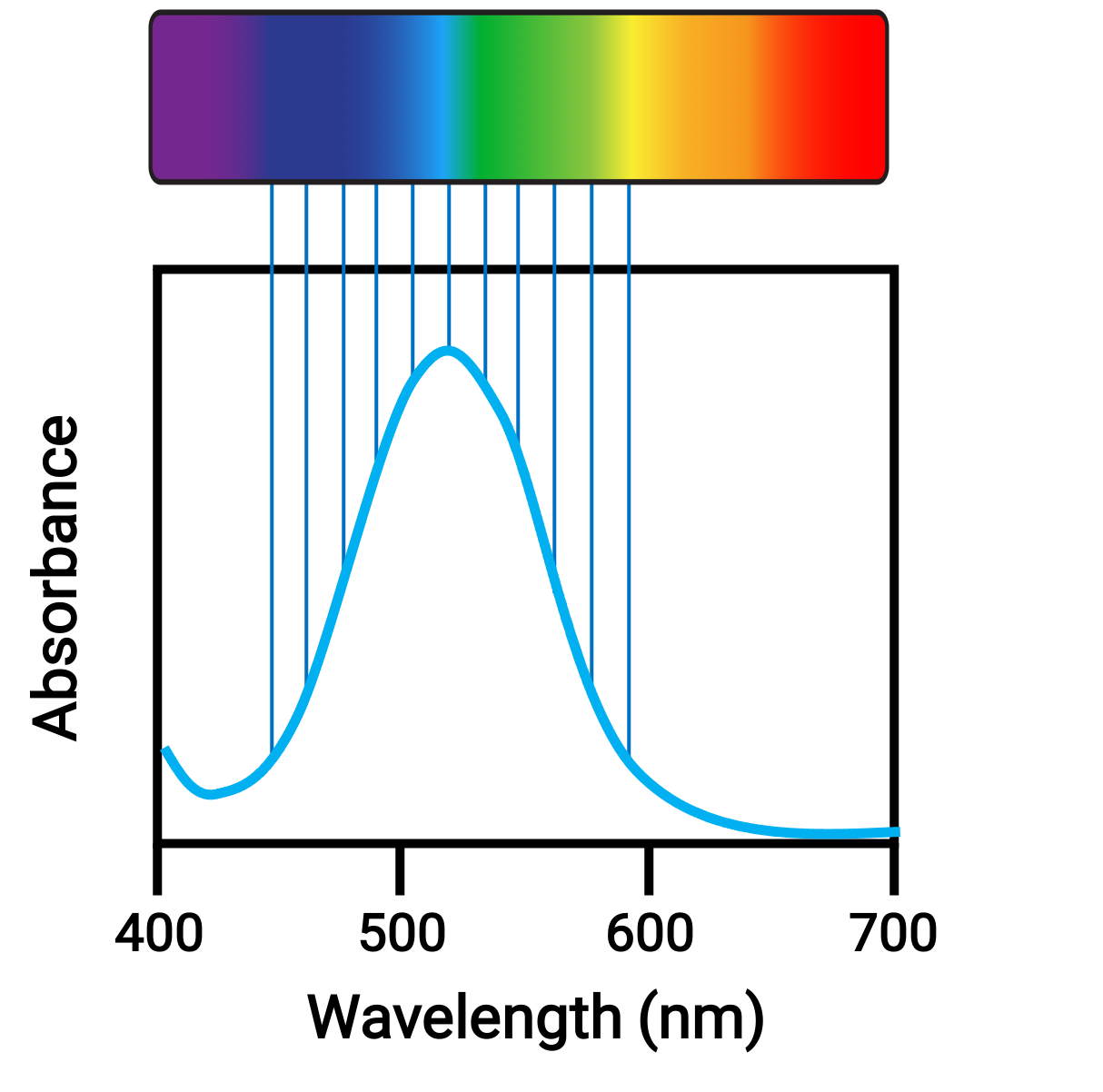
Figura 1. Espectro electromagnético de luz visible y absorbancia.
Pequeños cambios en las energías relativas de los orbitales entre los que los electrones están en transición pueden conducir a cambios drásticos en el color de la luz absorbida. Por lo tanto, los colores de los compuestos de coordinación dependen de muchos factores, como:
• Diferentes iones metálicos acuosos pueden tener diferentes colores.
• Diferentes estados de oxidación de un metal pueden producir diferentes colores.
• Los ligandos específicos coordinados con el centro de metal influyen en el color de los complejos de coordinación. Por ejemplo, el complejo hierro (II) [Fe(H2O)6]SO4 aparece de color verde-azul porque el complejo de alto giro absorbe fotones en las longitudes de onda rojas. En contraste, el complejo de hierro (II) de bajo centrifugado K4[Fe(CN)6] aparece de color amarillo pálido porque absorbe fotones violeta de mayor energía.
En general, los ligandos de campo fuerte causan una gran división en las energías de los orbitales d del átomo central de metal (Δ grande). Los compuestos de coordinación de metales de transición con estos ligandos son amarillos, naranjas o rojos porque absorben luz violeta o azul de mayor energía.
Por otro lado, los compuestos de coordinación de los metales de transición con ligandos de campo débil son a menudo de color verde-azul, azul o índigo porque absorben luz amarilla, naranja o roja de menor energía. La fuerza de los ligandos para dividir los orbitales d se indica en la serie espectrofotoquímica. Aquí los ligandos están escritos en orden creciente del valor de la energía de división del campo cristalino (Δ).
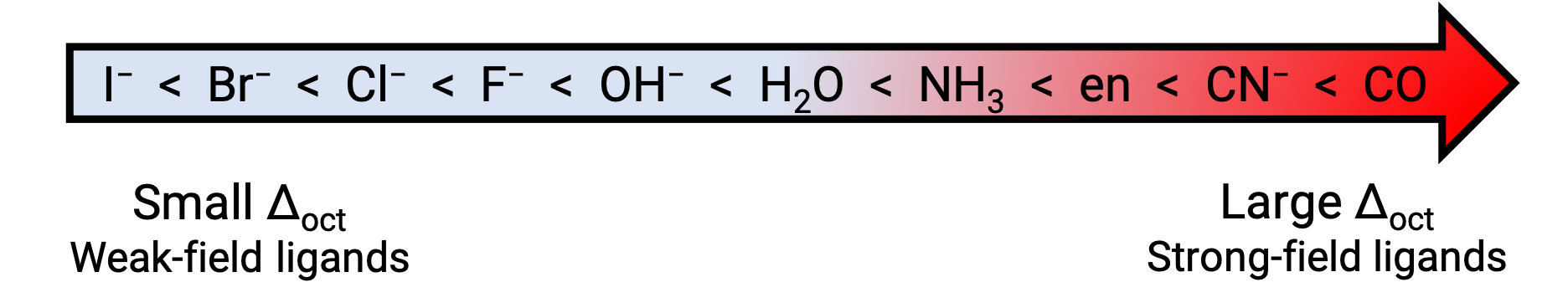
Figura 2. Serie espectroquímica.
Por ejemplo, un compuesto de coordinación del Cu+ tiene una configuración d10, y todos los orbitales eg están llenos. Para excitar un electrón a un nivel más alto, como el orbital 4p, son necesarios fotones de energía muy alta. Esta energía corresponde a longitudes de onda muy cortas en la región ultravioleta del espectro. No se absorbe ninguna luz visible, por lo que el ojo no ve ningún cambio y el compuesto aparece blanco o incoloro. Una solución que contiene [Cu(CN)2]−, por ejemplo, es incolora. Por otro lado, los complejos octaédricos Cu+ tienen una vacante en los orbitales eg, y los electrones pueden excitarse a este nivel. La longitud de onda (energía) de la luz absorbida corresponde a la parte visible del espectro, y los complejos Cu2+ casi siempre están coloreados: Azul, verde-azul, violeta o amarillo.
Magnetismo en los complejos de coordinación
La evidencia experimental de mediciones magnéticas apoya la teoría de complejos de alto y bajo espín. Las moléculas como O2 que contienen electrones no apareados son paramagnéticas. Las sustancias paramagnéticas son atraídas a los campos magnéticos. Muchos complejos metálicos de transición tienen electrones no apareados y por lo tanto son paramagnéticos. Moléculas como N2 e iones como Na+ y [Fe(CN)6]4− que no contienen electrones no apareados son diamagnéticos. Las sustancias diamagnéticas tienen una ligera tendencia a ser repelidas por los campos magnéticos.
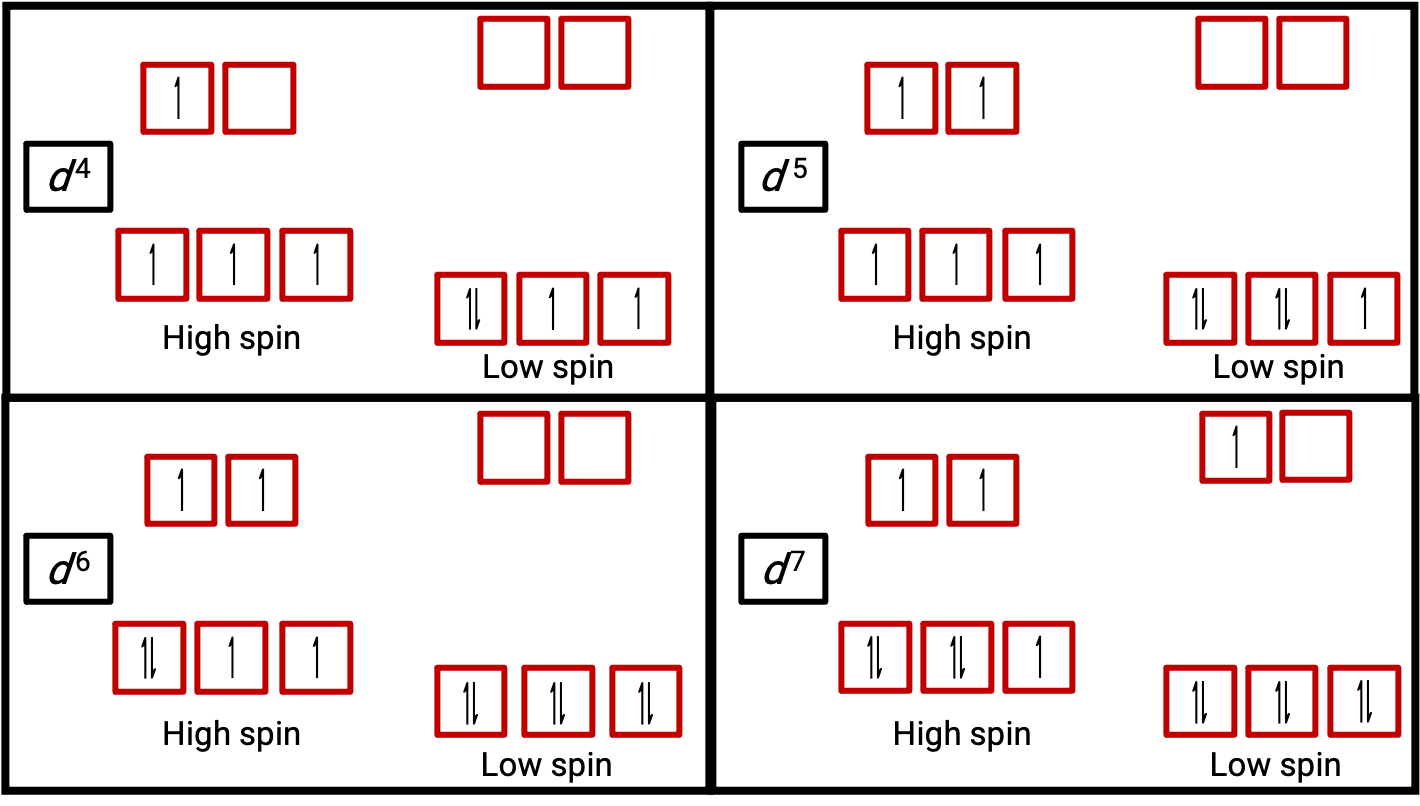
Figura 3. Diagramas orbitales de los complejos octaédricos en estado de alto y bajo espín para los sistemas d4, d5, d6, y d7. Esta distinción no puede hacerse para los sistemas d1, d2, d3, d5, d8,d9 and d10.
Cuando un electrón en un átomo o ión es desapareado, el momento magnético debido a su giro hace que todo el átomo o ion sea paramagnético. El tamaño del momento magnético de un sistema que contiene electrones no apareados está relacionado directamente con el número de tales electrones: Cuanto mayor sea el número de electrones no apareados, mayor será el momento magnético. Por lo tanto, el momento magnético observado se utiliza para determinar el número de electrones no apareados presentes. El momento magnético medido de bajo espín d6 [Fe(CN)6]4− confirma que el hierro es diamagnético, mientras que el de alto espín d6 [Fe(H2O)6]2+ tiene cuatro electrones no apareados con un momento magnético que confirma esta disposición (Figura 2).
Este texto está adaptado de Openstax, Química 2e, Section19.3: Propiedades espectroscópicas y magnéticas de los compuestos de coordinación.
