Overview
ソース: 博士マイケル ・ エヴァンスの研究所、ジョージア工科大学
化学システムの平衡定数Kは、製品のそれぞれの化学量論係数の指数で累乗それぞれ平衡反応物濃度を濃度の比率です。Kの測定には、化学平衡のシステムのためのこれらの濃度測定が含まれます。
光光度法による単一の着色されたコンポーネントを含む反応系を学ぶことができます。着色成分の濃度と吸光度の関係を測定、関心の反応系でその濃度を決定するために使用します。無色成分濃度は、バランスの取れた化学方程式と着色成分濃度の測定を使用して直接計算できます。
このビデオで Fe(SCN)2 +ビールの法の曲線は、経験的に決定、 Kの次の反応のための測定に適用。
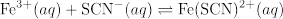
反応の初期濃度の異なる 4 つの反応系が示すためにK初期濃度に関係なく一定に保持される調査します。
Principles
すべての化学反応の平衡定数K、製品濃度化学平衡で、反応物の濃度の比を反映するに関連付けられます。一般的な反応、 A + b B として平衡定数を定義c C + d D、
として平衡定数を定義c C + d D、

式の右側の濃度が平衡でモルです。この方程式は、反作用のための平衡式と呼ばれます。化学平衡にはないシステムで前方および逆反作用は反応物の濃度まで、異なるレートで、製品は、平衡の式を満たします。
化学平衡のシステムのためのK値を測定するには、直接または間接的に反応し製品の濃度を決定する必要は。Kによる吸光光度法は、1 つの着色成分の濃度の直接測定とその他の間接測定を含みます。既知濃度の色コンポーネントの可視分光法では、このコンポーネントの濃度と吸光度との関係を明らかにします。ビールの法律によると、この関係はフォーム

e は L/mol cm、 l成分のモルの吸収率はモル濃度 mol/L でのコンポーネントのであり、 Aは吸光度のサンプル cm、 cを光パスの長さ。
色コンポーネントのビールの法の曲線は、吸光度測定 (図 1) からこのコンポーネントの濃度平衡反応システムに適用できます。残りの反応と製品の濃度は、色種のモル濃度測定に基づく初期濃度を調整することにより計算できます。
ここで学んだシステム チオシアン酸の鉄 (III) 塩複合を形成するチオシアン酸陰イオンと鉄 (III) イオンの反応であります。

この反応系の平衡式です。

ここeqの添字で平衡濃度を表します。製品は、チオシアン酸鉄 (III) はオレンジ、しかし、両方の反応は水溶液中で無色。したがって、[Fe(SCN)2 +]eqは、吸光測定から直接確認できます。

反応の平衡濃度は、反応の初期濃度から製品の平衡濃度を差し引くことによって計算できます。初期変更平衡 (ICE) テーブルは、初期および平衡濃度の関係を示します (表 1)。

Kの値は濃度に依存しない反応の初期濃度を含むこの実験の繰り返し試験Kの同じ値が生成されるはず。

図 1。チオシアン酸鉄 (III) のビールの法の曲線。
| Fe3 + | SCN- | Fe(SCN)2 + | |
| 初期 | [Fe3 +]私 | [SCN-]私 | 0 |
| 変更 | –[Fe(SCN)2 +]eq | –[Fe(SCN)2 +]eq | +[Fe(SCN)2 +]eq |
| 平衡 | [Fe3 +]私-[Fe(SCN)2 +]eq | [SCN-]私-[Fe(SCN)2 +]eq | [Fe(SCN)2 +]eq |
表 1。初期および平衡濃度の関連を示す初期変更平衡 (ICE) テーブル。
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. Fe(SCN)2 +ビールの法の曲線を決定します。
- 空白として蒸留水を使用して可視分光光度計を調整します。
- 1.0 × 10-4 M Fe(NO3)3ソリューションの 1.0 mL を試験管に追加します。
- 同じ試験管 0.50 M KSCN 溶液 5.0 mL を追加します。
- 同じ試験管 0.10 M HNO3液 4.0 mL を追加します。手袋をはめた指でチューブをカバーし、ミックスに軽く振る。
- パスツール ピペットを使用してソリューションの少量をキュベットに転送。分光光度計の光ビームのパス上液面が確実します。
- 透明な側面を光が通過するので、分光光度計のキュヴェットを。
- スペクトルを取得し、λmax値と λmaxで吸光度を記録します。
- ビールの法の曲線を構築するために既知濃度 Fe(SCN)2 +追加のソリューションは準備し、測定する必要があります。手順 2-7 Fe (3)3KSCN、ボリュームを使用して表 2の HNO3ソリューション。
- Fe(SCN)2 +各試験管内の濃度と測定した吸光度をプロットし、データに最適のラインを決定します。この直線の傾きはモルの吸収率、パスの長さが 1 cm。
2. 鉄 (III) チオシアン酸系のKを測定
- 0.0025 M Fe (3)3、0.0025 M KSCN と表 3に 0.10 M HNO3ソリューションの指定されたボリュームを含む 4 中試験管を準備します。
- 指でチューブをカバーし、ミックスに軽く振る。少なくとも 10 分のために立つことを許可します。この休憩期間により、ソリューションが化学平衡であります。
- パスツール ピペットを使用してソリューション 6 の少量をキュベットに転送。分光光度計の光ビームのパス上液面が確実します。
- スペクトルを取得し、λmax値と λmaxで吸光度を記録します。
- 反応の初期濃度の異なる複数の反応研究できることを示すためにKは濃度に依存しません。さまざまな初期条件のKを決定する、ソリューション 7-9 の手順 3 と 4 を繰り返します。
| 管番号 | ボリューム 10–4 M Fe (3)3 (mL) x 1.0 |
ボリューム 0.50 M KSCN (mL) |
ボリューム 0.10 M HNO3 (mL) |
| 1 | 1.0 | 5.0 | 4.0 |
| 2 | 2.0 | 5.0 | 3.0 |
| 3 | 3.0 | 5.0 | 2.0 |
| 4 | 4.0 | 5.0 | 1.0 |
| 5 | 5.0 | 5.0 | 0.0 |
表 2。Fe (3)3KSCN、HNO のボリュームを適切な管 2-5 に配置する3ソリューション。
| 管番号 | ボリューム 0.0025 M Fe (3)3 (mL) |
ボリューム 0.0025 M KSCN (mL) |
ボリューム 0.10 M HNO3 (mL) |
| 6 | 1.0 | 1.0 | 5.0 |
| 7 | 1.0 | 2.0 | 4.0 |
| 8 | 2.0 | 2.0 | 3.0 |
| 9 | 2.0 | 3.0 | 2.0 |
表 3。0.0025 M Fe (3)3、0.0025 M KSCN 0.10 M HNO3ソリューションの適切なボリューム。
化学反応の平衡定数を決定することができます製品を提供それが形成する程度に関する重要な情報時間をかけて。
すべての化学反応の平衡定数、K は、反応の進行が停止すると製品や反応物質の濃度比を反映しているに関連付けられます。K を測定するには、これらの濃度を決定する必要があります。
反応には、単一の着色成分が含まれている場合、は、その濃度を検知する光との相互作用を測定できます。未塗装の成分濃度は、バランスの取れた化学方程式を使用して直接計算できます。このビデオは、鉄の thiocyanante 反応の平衡定数を経験的判断に分光光度計の使用を説明します。
ほとんどの化学反応は、前方および逆方向に進みます。反応が進むにつれて前方および逆の反応が同じ速度で発生するポイントに達する。これは、化学平衡と呼ばれます。この定常状態で反応物濃度を彼らの化学量論係数の電源に発生した各製品濃度の比が平衡定数、k. に対応します。計る K 興味のシステムのための係数は、知られているべきであると直接または間接的に、濃度を決定する必要があります。ビール-ランベルトの法則によると色種の濃度はその吸光度に比例して光の特定波長を吸収するエネルギーの量であります。これは数学的に表現することができます、場所Aは吸光度、イプシロンは特定の化合物であるモルの減衰係数、 lは、サンプルを介してパスの長さ、 c濃度。検量線を作成するには、濃度既知の複数のソリューションをテストし、結果の吸光度値をプロットします。この検量線で未知濃度の溶液を学ぶことができます。吸光測定、色種の濃度を決定するために使用されます。その後、残りの反応と製品の濃度を計算できます。次の手順は、鉄 3、鉄チオシアン酸の複合を形成するチオシアン酸との反応を検討します。
濃度が決定されると、値 K は初期変更平衡や氷と計算することができますテーブルの結果で更に説明されます。
今がわかる、吸光光度法は、平衡定数を決定する使用ことができます、どのように手順を開始する準備が整いました。
サンプルを測定する前に検量線を生成する必要があります。
0 を開始するには、吸光度を表すない空白として水を蒸留紫外可視分光光度計を使用しています。分光光度計のキュベット挿入しているとき、透明な側面を光が通過するように、それは指向は、液レベルはビームのパス上を確認します。
製品のさまざまな濃度をもたらすテキスト プロトコルで示すように、各反応溶液の指定されたボリュームを含む 5 試験管を準備します。手袋をはめた指で、各管をカバーし、ミックスに軽く振る。10 分、パスツール ピペット、キュベットにソリューション 1 の少量を転送するし、分光光度計の使用の残りの部分にチューブを許可します。スペクトルを取得し、λmax し、その吸光度を記録します。ソリューション 2-5 の実行ごとに新しいキュヴェットを使用してこの手順を繰り返します。
各ソリューションの鉄チオシアン酸の濃度と測定した吸光度をプロットします。データに最適のラインを決定します。この直線の傾きは、大臼歯の減衰係数です。
今では標準的なソリューションのデータを取得すると、テキスト プロトコルのようにソリューションの指定されたボリュームを含む 4 つの中試験管を準備します。
指でチューブをカバーし、ミックスに軽く振る。少なくとも 10 分のために立つことを許可します。この休息期間により、化学平衡に到達するソリューションです。
パスツール ピペットを使用してソリューション 6 の少量をキュベットに転送し、分光光度計。スペクトルを取得し、λmax の値と、λmax で測定した吸光度を記録します。7-9 のソリューションには、このプロセスを繰り返します。
すべてのサンプルが測定されている、一度ソリューション 1-5 モル濃度と吸光度のデータを分析できます。大過剰のチオシアン酸鉄のすべての反応、分析を簡素化することを確認する使用されました。
検量線を作成するデータがプロットされます。光のパスの長さ l、1 cm は、通常、計算からは除外することができます。7600 に計算された直線の傾きは、したがって減衰係数です。テスト ソリューション 6-9、この値と吸光度は平衡で鉄チオシアン酸イ オン濃度を計算する使用します。このデータと氷表を利用する可能性がありますし。
初期の反応物濃度は、鉄とチオシアン酸のソリューション、および反応の総ボリュームに追加の既知のモルに基づいています。製品は、鉄とチオシアン酸の 1:1 の反応から形成されている、ので各製品の量減少の平衡濃度が形成されました。それぞれの種の平衡濃度は今知られています。これらの値は、各ソリューションのための平衡定数の計算に使用されます。値は、検討濃度の範囲でほぼ一定。
平衡定数の概念は、科学分野の広い範囲に重要です。平衡定数は、時間の経過とともに反応を形成する程度に関する有用な情報製品を提供するために使用できます。この例ではクリスタル バイオレットを含む 2 つの反応が認められました。
最初のソリューションは、クリスタル バイオレットと水酸化ナトリウムで構成だった。色は、紫色から無色に急速に変更する観察されました。この反応は、製品を時間をかけてほぼ完全に形成することを示す、非常に大規模な K 値を持ちます。
クリスタル バイオレット、酢酸ナトリウムと反応しました。このソリューションは、無期限に紫残った。この反応では、前方はかなりの程度まで続行されません。 低 K 値。
最後に、解離定数、平衡定数の特定の種類-タンパク質の挙動を記述するため使用することができます。この例ではマグネシウム反応バッファーに RNA の構造の変化を調べた。
浄化された RNA はソリューションにマグネシウム、既知濃度と混合され、平衡に到達する許可。その後、結果として得られる RNA の構造をプロットしました。
この場合、マグネシウムの高濃度は、半分の値だった Kd 生産より少なく保護される RNA の反応部位を発生します。
平衡定数の吸光光度定量のゼウスの概要を見てきただけ。今ビール ランベルトの法則、分光光度計を使用して吸光度から濃度を決定する方法、および平衡濃度を用いた平衡定数を計算する方法で定義されている関係を理解する必要があります。
見てくれてありがとう!
Subscription Required. Please recommend JoVE to your librarian.
Results
表 4には、解決策 1-5 の吸光度と濃度のデータが一覧表示されます。Fe3 +すべての Fe3 +が Fe(SCN)2 +に変換されている仮定の下での最初の集中からの Fe(SCN)2 +濃度を測定しました。大過剰の SCN-は、この前提が true を保持していることを確保するため管 1-5 で使用されました。
[Fe(SCN)2 +] モル濃度と吸光度は図 2でプロットされます。測定結果は、ビールの法律も同意します。
表 5は、測定吸光度とチューブ 6-9 の計算のK値を示します。K値は、アイス テーブル メソッドを使用して決定されました。初期の反応物濃度は、Fe3 +と SCN-反応溶液中の既知のモルと反応 (10 mL) の容量に基づいていた。Fe(SCN)2 +の平衡濃度は、Fe(SCN)2 +のモルの吸収によって分割測定した吸光度によって決定されました。すべての製品は、Fe3 +と SCN-の 1:1 の反応で形成されたので Fe(SCN)2 +の平衡濃度は、低下反応物の濃度に相当します。表 6は、試験管 6 のプロセスを示しています。
平衡定数は、平衡行中の濃度から計算されます。テスト チューブ 6、

K値の平均があった 147 ± 11、検討濃度の範囲で、 Kがほぼ一定を示します。

図 2。Fe(SCN) の濃度と吸光度の線グラフ2 +.
| チューブ | [Fe(SCN)2 +](mol/L) | 吸光度 |
| 1 | 10–5 x 1.00 | 0.10 |
| 2 | 10–5 x 2.00 | 0.20 |
| 3 | 10–5 × 3.00 | 0.25 |
| 4 | 10–5 x 4.00 | 0.32 |
| 5 | 10–5 x 5.00 | 0.42 |
表 4。Fe(SCN) の濃度のデータ対の吸光度2 +.
| チューブ | 吸光度 | K |
| 6 | 0.120 | 136 |
| 7 | 0.268 | 161 |
| 8 | 0.461 | 142 |
| 9 | 0.695 | 150 |
表 5。吸光度値と計算される K チオシアン酸鉄 (III) の反応を測定します。
| [Fe3 +](mol/L) | [SCN-](mol/L) | [Fe(SCN)2 +](mol/L) | |
| 初期 | 10–4 × 3.57 | 10–4 × 3.57 | 0 |
| 変更 | –1.58 x 10–5 | –1.58 x 10–5 | +1.58 x 10–5 |
| 平衡 | 10–4 × 3.41 | 10–4 × 3.41 | 10–5 × 1.58 |
表 6。テスト チューブ 6 に使用されるプロセスを示していますアイス テーブル。
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
平衡定数は、時間をかけて形に進んでください反応は、程度に関する有用な情報を提供します。K、1 よりもはるかに大きい値が大きい反応は製品のほぼ完全な十分な時間 (図 3) を形成します。K 1 未満の値を持つ反応はかなりの程度まで楽しみにして進みません。平衡定数はこのように化学反応の可能性の尺度として機能します。

図 3。この反応の平衡定数が 1 より大きいです。反応の初期濃度が異なるにもかかわらず、色の製品のかなりの量はそれぞれのケースで形成します。
平衡定数は、自由エネルギー、エンタルピー、および化学反応の過程でエントロピーの変化についての熱力学的情報を提供します。平衡定数は次の反応の自由エネルギー変化の関連します。

反応の自由エネルギー変化に反応のエンタルピーとエントロピーの変更に関連しています。

Kの温度依存性の測定は、エンタルピー変更 ΔHとエントロピー変更 ΔSの反応を明らかにできます。とともに、化学分子の挙動パターンへの洞察力、熱力学データのテーブルは有利な熱力学的性質と反応を識別するために使用できます。たとえば、大量のエネルギー (負 ΔG値に関連付けられている) を解放する酸化還元反応、電池の魅力的な候補です。
酸解離反応(値K)のKの値は、熱力学的に制御される酸塩基反応の結果を予測するのに役立ちます。強い酸は大K値および弱い酸小Kの値に関連付けられます。pH 指示薬が異なる色の酸性および基本的なフォームと弱い酸を表し、pK、 ( Kの負の常用対数) インジケーターの pH、酸として発生する色の変化またはベースがインジケーターのソリューションに追加されます。
同様に、値にKは、目標 pH 値を達成するために緩衝溶液の調製に使用されます。PK、弱い酸の酸と共役基盤が等しい濃度の溶液中に存在する pH を表します。弱い酸のとき同量しその共役塩基が溶液に溶けると、pK、弱い酸の解決の pH に等しくなります。
Subscription Required. Please recommend JoVE to your librarian.




