Overview
Quelle: Labor von Dr. Michael Evans, Georgia Institute of Technology
Die Gleichgewichts-Konstante K, chemisches System ist das Verhältnis der Produktkonzentrationen Edukt-Konzentrationen im Gleichgewicht, jeweils potenziert mit ihren jeweiligen stöchiometrischen Koeffizienten. Messung der K beinhaltet Entschlossenheit diese Konzentrationen für Systeme im chemischen Gleichgewicht.
Reaktionssysteme, enthält eine einzelne farbige Komponente können spektralphotometrisch untersucht werden. Das Verhältnis zwischen Extinktion und Konzentration für die farbigen Komponente gemessen und zur Ermittlung die Konzentration im Reaktionssystem von Interesse. Konzentrationen der farblosen Komponenten können indirekt über die ausgeglichene Reaktionsgleichung und die gemessene Konzentration der farbigen Komponente berechnet werden.
In diesem Video ist das Bier recht Kurve für Fe(SCN)2 + empirisch ermittelt und auf die Messung der K für die folgende Reaktion:
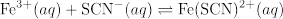
Vier Reaktionssysteme mit verschiedenen anfängliche Konzentrationen der Edukte werden untersucht, um veranschaulichen, die K unabhängig von der anfänglichen Konzentration konstant bleibt.
Principles
Jede chemische Reaktion ist eine Gleichgewichts-Konstante K, widerspiegelt das Verhältnis der Produktkonzentrationen Edukt-Konzentrationen im chemischen Gleichgewicht zugeordnet. Für die allgemeine Reaktion ein A + b B  c C + d D die Gleichgewichts-Konstante ist definiert als
c C + d D die Gleichgewichts-Konstante ist definiert als

wo sind die Konzentrationen auf der rechten Seite der Gleichung Molarities im Gleichgewicht. Diese Gleichung ist als Ausdruck für die Reaktion Gleichgewicht bekannt. In chemischen Systemen, die nicht im Gleichgewicht befinden, die vorwärts und rückwärts Reaktionen auftreten mit unterschiedlichen Geschwindigkeiten bis die Konzentrationen der Edukte und Produkte erfüllen die Gleichgewicht-Ausdruck.
Um den Wert von K für ein System im chemischen Gleichgewicht zu messen, ist es notwendig, die Konzentrationen der Edukte und Produkte direkt oder indirekt bestimmen. Photometrische Methoden zur Bestimmung von K beinhalten direkte Messung der Konzentration von einer farbigen Komponente und indirekte Messung der anderen. Sichtbare Spektroskopie der farbigen Komponente bei bekannten Konzentrationen zeigt den Zusammenhang zwischen Extinktion und Konzentration für diese Komponente. Nach dem Gesetz des Bieres hat diese Beziehung die form

wo e Molares Absorptionsvermögen des Bauteils in Mol/L-cm, l ist die Weglänge des Lichtes durch die Probe in cm, c ist das Molarity der Komponente in Mol/L, und A ist die Extinktion.
Das Bier recht Kurve für die farbigen Komponente kann auf eine Reaktionssystem im Gleichgewicht zur Bestimmung der Konzentration dieser Komponente von Extinktion Messungen (Abbildung 1) angewendet werden. Konzentrationen der Edukte und Produkte können dann berechnet werden, indem Sie anfängliche Konzentration anhand der gemessenen Molarity der farbigen Arten anpassen.
Die hier untersuchten System ist die Reaktion von Eisen (III) kation mit Thiocyanat Anion, ein Eisen (III)-Thiocyanat-Komplex bilden.

Der Gleichgewicht-Ausdruck für dieses Reaktionssystem ist

wo der Eq -Index Gleichgewichtskonzentrationen bezeichnet. Das Eisen (III)-Thiocyanat-Produkt ist Orange, aber beide Edukte sind in wässriger Lösung farblos. [Fe(SCN)2 +]Eq kann daher direkt von Extinktion Messungen ermittelt werden.

Gleichgewichtskonzentrationen der Edukte können berechnet werden durch Subtraktion der Gleichgewicht-Konzentration des Produkts von der ursprünglichen Konzentrationen der Edukte. Eine Initial-Änderung-Gleichgewicht (ICE) Tabelle veranschaulicht, wie aus- und Gleichgewicht Konzentrationen zusammenhängen (Tabelle 1).

Wiederholte Versuche dieses Experiment mit verschiedenen anfängliche Konzentrationen der Reaktanden sollte den gleichen Wert von K, Ausbeute, da der Wert von K unabhängig von der Konzentration.

Abbildung 1. Bier Gesetz für Eisen (III) Thiocyanat Kurve.
| Fe3 + | SCN– | Fe(SCN)2 + | |
| Anfängliche | [Fe3 +] Ich | [SCN–] Ich | 0 |
| Änderung | –[Fe(SCN)2 +]eq | –[Fe(SCN)2 +]eq | +[Fe(SCN)2 +]eq |
| Gleichgewicht | [Fe3 +] ich – [Fe(SCN)2 +]eq | [SCN–] ich – [Fe(SCN)2 +]eq | [Fe(SCN)2 +] EQ |
Tabelle 1. Eine Initial-Änderung-Gleichgewicht (ICE) Tabelle, die zeigt, wie aus- und Gleichgewicht Konzentrationen zusammenhängen.
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. bestimmen das Bier recht Kurve für Fe(SCN)2 +
- Eine sichtbare Spektralphotometer mit destilliertem Wasser als eine leere zu kalibrieren.
- 1,0 mL 1,0 × 10-4 M Fe(NO3)3 Lösung in einem Teströhrchen zugeben.
- Zugeben Sie in der gleichen Teströhrchen 5,0 mL 0,50 M KSCN-Lösung.
- Hinzugeben Sie in der gleichen Teströhrchen 4,0 mL 0,10 M Druckaufschluss3 Lösung. Das Rohr mit einem behandschuhten Finger abdecken und schütteln um zu mischen.
- Verwenden Sie eine Pasteurpipette eine kleine Menge der Lösung in einer Küvette übertragen. Sicherstellen Sie, dass der Flüssigkeitsstand über dem Weg des Lichtstrahls im Spektralphotometer.
- Legen Sie die Küvette im Spektralphotometer, so dass das Licht durch die transparenten Seiten geht.
- Erwerben Sie ein Spektrum zu und zeichnen Sie der λ-max -Wert und die Extinktion bei λmax auf.
- Um ein Bier recht Kurve konstruieren, müssen zusätzliche Lösungen mit bekannten Konzentrationen von Fe(SCN)2 + vorbereitet und gemessen werden. Wiederholen Sie die Schritte 2 – 7 mit den Bänden der Fe (Nr.3)3, KSCN, und Druckaufschluss3 Lösungen in Tabelle 2.
- Die gemessene Extinktion gegen die Konzentrationen von Fe(SCN)2 + in jedes Reagenzglas des Grundstückes und die Linie der besten Passform für die Daten zu bestimmen. Die Steigung dieser Linie ist die molare Aufnahmefähigkeit und die Weglänge beträgt 1 cm.
2. Messung K für das Eisen (III)-Thiocyanat-System
- Bereiten Sie 4 mittlere Reagenzgläser mit den angegebenen Bänden von 0,0025 M Fe (Nr.3)3, 0.0025 M KSCN und 0,10 M Druckaufschluss3 Lösungen in Tabelle 3 vor.
- Jedes Rohr mit einem Finger zu decken und schütteln um zu mischen. Für mindestens 10 Minuten stehen lassen. Diese Ruhe sorgt für Periode die Lösungen im chemischen Gleichgewicht.
- Verwenden Sie eine Pasteurpipette, um eine kleine Menge der Lösung 6 auf eine Küvette zu übertragen. Sicherstellen Sie, dass der Flüssigkeitsstand über dem Weg des Lichtstrahls im Spektralphotometer.
- Erwerben Sie ein Spektrum zu und zeichnen Sie der λ-max -Wert und die Extinktion bei λmax auf.
- Mehrere Reaktionen mit verschiedenen anfängliche Konzentrationen der Edukte können untersucht werden, um zu veranschaulichen, die K nicht von der Konzentration abhängt. Um K für unterschiedliche Anfangsbedingungen bestimmen, wiederholen Sie die Schritte 3 und 4 für Lösungen 7 – 9.
| Röhre Nummer | Volumen 1.0 x 10– 4 M Fe (Nr.3)3 (mL) |
Volumen 0,50 M KSCN (mL) |
Volumen 0,10 M Druckaufschluss3 (mL) |
| 1 | 1.0 | 5.0 | 4.0 |
| 2 | 2.0 | 5.0 | 3.0 |
| 3 | 3.0 | 5.0 | 2.0 |
| 4 | 4.0 | 5.0 | 1.0 |
| 5 | 5.0 | 5.0 | 0.0 |
Tabelle 2. Entsprechende Mengen an Fe (Nr.3)3, KSCN und Druckaufschluss3 Lösungen in Röhren 2-5 platziert werden.
| Röhre Nummer | Volumen 0,0025 M Fe (Nr.3)3 (mL) |
Volumen 0,0025 M KSCN (mL) |
Volumen 0,10 M Druckaufschluss3 (mL) |
| 6 | 1.0 | 1.0 | 5.0 |
| 7 | 1.0 | 2.0 | 4.0 |
| 8 | 2.0 | 2.0 | 3.0 |
| 9 | 2.0 | 3.0 | 2.0 |
Tabelle 3. Entsprechende Mengen von 0,0025 M Fe (Nr.3)3, 0.0025 M KSCN und 0,10 M Druckaufschluss3 Lösungen.
Bestimmen die Gleichgewichts-konstante einer chemischen Reaktion kann liefern wichtige Informationen über das Ausmaß, das es bilden, Produkte im Laufe der Zeit.
Jede chemische Reaktion ist verbunden mit einer konstanten Gleichgewicht, K, die das Verhältnis der Konzentrationen der Produkte und Edukte reflektiert, wenn die Reaktion beendet wurde voran. Um K zu messen, müssen diese Konzentrationen bestimmt werden.
Wenn eine Reaktion eine einzelne farbigen Komponente enthält, kann seine Wechselwirkung mit Licht gemessen werden, um seine Konzentration zu erkennen. Die Konzentrationen der einzelnen ungefärbten können dann indirekt mit der ausgeglichene Reaktionsgleichung berechnet werden. Dieses Video wird die Verwendung von einem Spektrophotometer empirisch bestimmen die Gleichgewichts-Konstante für eine Eisen-Thiocyanante-Reaktion zu veranschaulichen.
Die meisten chemische Reaktionen verlaufen in vorwärts-und rückwärts. Da die Reaktion fortschreitet es erreicht einen Punkt, wo die vorwärts- und Reaktionen, mit der gleichen Rate auftreten. Dieses bekannt als chemischen Gleichgewicht. Bei dieser Steady-State entspricht das Verhältnis der Produktkonzentrationen Edukt-Konzentrationen, jeweils potenziert mit ihrer stöchiometrischen Koeffizienten, die Gleichgewichts-Konstante K. Nach Maß K für ein System von Interesse die Koeffizienten sollte bekannt sein, und die Konzentrationen müssen ermittelt werden, entweder direkt oder indirekt. Nach dem Bier-Lambert Gesetz ist die Konzentration von einem farbigen Arten proportional zu seiner Absorption der Energiemenge, die bei einer bestimmten Wellenlänge des Lichts absorbiert. Mathematisch ausgedrückt werden kann, wo A ist Extinktion, Epsilon ist die molare Dämpfung-Koeffizienten, die substanzspezifischen l ist die Länge des Pfads durch die Probe und c ist die Konzentration. Eine Kalibrierkurve entsteht durch die Tests mehrere Lösungen bekannter Konzentration und Plotten die Ergebniswerte der Extinktion. Mit diesem Eichkurve können Lösungen unbekannter Konzentration untersucht werden. Extinktion Messungen dienen zur Bestimmung der Konzentration der farbigen Arten. Dann können die Konzentrationen der Edukte und Produkte berechnet werden. Das folgende Verfahren wird die Reaktion des Eisens drei mit Thiocyanat, ein Eisen-Thiocyanat-Komplex bilden studieren.
Sobald die Konzentrationen festgestellt wurden, Tabelle der Wert für K mit einem Initial-Änderung-Gleichgewicht oder Eis, berechnet werden kann, erläutert werden weiter in den Ergebnissen.
Nun, da Sie verstehen wie photometrische Methoden zu bestimmen, die Gleichgewichts-Konstante verwendet werden können, sind Sie bereit, das Verfahren zu beginnen.
Vor der Messung der Probenmaterials muss eine Kalibrierungskurve generiert werden.
Um zu beginnen, Null destilliertem eines UV-Vis Spektralphotometer mit Wasser als eine leere, keine Absorption zu vertreten. Beim Einfügen einer Küvette in das Spektrophotometer sicherzustellen Sie, dass es ausgerichtet ist, so dass Licht durch die transparenten Seiten fällt und der Flüssigkeitsstand über dem Pfad des Balkens ist.
Dann bereiten Sie 5 Reagenzgläser mit den angegebenen Bänden der jeweiligen Reaktanten Lösung wie im Text Protokoll, die unterschiedliche Konzentrationen des Produkts Ausbeute wird gezeigt. Jedes Rohr mit einem behandschuhten Finger zu decken, und schütteln um zu mischen. Lassen Sie die Röhrchen für 10 min. Einsatz einer Pasteur pipette, um eine kleine Menge der Lösung 1 in eine Küvette zu übertragen, und platzieren Sie es im Spektralphotometer ruhen. Erwerben Sie ein Spektrum zu und dokumentieren Sie die λmax und seine Absorption. Wiederholen Sie diesen Vorgang für Lösungen 2 – 5, mit einem neuen Küvette für jeden Lauf.
Darstellen Sie die gemessene Extinktion gegen Konzentration von Eisen Thiocyanat für jede Lösung. Die Linie der beste Passform für die Daten zu bestimmen. Die Steigung dieser Linie ist der molaren Dämpfung-Koeffizient.
Nun, da die Daten für die standard-Lösungen erworben hat, bereiten Sie vier mittlere Reagenzgläser mit den angegebenen Bänden Lösungen wie in dem Text Protokoll dargestellt.
Jedes Rohr mit einem Finger zu decken und schütteln um zu mischen. Für mindestens 10 Minuten stehen lassen. Diese Ruhezeit kann die Lösungen zum chemischen Gleichgewicht zu erreichen.
Verwenden Sie einer Pasteurpipette, um eine kleine Menge der Lösung 6 auf eine Küvette zu übertragen, und platzieren Sie es im Spektralphotometer. Erwerben Sie ein Spektrum zu und notieren Sie den λmax-Wert und die Extinktion gemessen an den λmax. Wiederholen Sie diesen Vorgang für Lösungen 7 – 9.
Sobald alle Proben gemessen wurden, können die Molarity und Extinktion Daten für Lösungen 1 – 5 analysiert werden. Einem großen Überschuss von Thiocyanat wurde verwendet, um sicherzustellen, dass alle das Eisen die vereinfacht die Analyse reagierten.
Die Daten werden eine Eichkurve erstellen gezeichnet. Die Weglänge des Lichtes, l, ist in der Regel 1 cm und können aus den Berechnungen berücksichtigt werden. Die Steigung der geraden, die zu 7600 berechnet wurde, ist daher der Dämpfung-Koeffizient. Für Testlösungen 6 – 9 gibt dieser Wert und die Extinktion verwendet, um die Eisen-Thiocyanat-Konzentrationen im Gleichgewicht berechnen. Mit diesen Daten könnten dann der ICE Tisch genutzt werden.
Die anfänglichen Reaktionspartner Konzentrationen basieren auf den bekannten Molarities von Eisen und Thiocyanat hinzugefügt, um die Lösung und das Gesamtvolumen der Reaktion. Da das Produkt aus der 1:1 Reaktion von Eisen und Thiocyanat gebildet wird, gebildet die Gleichgewicht-Konzentration von jedem sinkt durch die Menge des Produktes. Die Gleichgewicht-Konzentration der einzelnen Arten ist nun bekannt. Diese Werte werden verwendet, um die Gleichgewichts-Konstante für jede Lösung zu berechnen. Die Werte sind etwa konstant über den Bereich der Konzentrationen untersucht.
Das Konzept der konstanten Gleichgewicht ist wichtig, den unterschiedlichsten wissenschaftlichen Bereichen. Die Gleichgewichts-Konstante kann verwendet werden, um nützliche Informationen über das Ausmaß, das eine Reaktion bilden, Produkte im Laufe der Zeit. In diesem Beispiel wurden zwei Reaktionen mit Kristallviolett beobachtet.
Die erste Lösung bestand aus Kristallviolett und Natriumhydroxid. Die Farbe wurde beobachtet, die schnelle Änderung von lila zu farblos. Diese Reaktion hat einen sehr großen K-Wert, darauf hinweist, dass die Produkte fast vollständig im Laufe der Zeit bilden.
Kristallviolett wurde dann mit Natriumacetat reagiert. Diese Lösung blieb lila auf unbestimmte Zeit. Diese Reaktion hat einen sehr niedrigen K-Wert, so dass es nicht nach vorne zu einem bedeutenden Grad fort.
Zu guter Letzt die Dissoziationskonstante – eine bestimmte Art von Gleichgewicht Konstante — kann verwendet werden, um Protein-Verhalten zu beschreiben. In diesem Beispiel wurden Änderungen in der Struktur der RNA in Magnesium Reaktion Puffern überwacht.
Gereinigte RNA wurde mit bekannten Konzentrationen von Magnesium in Lösung gemischt und erlaubt, Gleichgewicht zu erreichen. Dann wurde die entstehende RNA-Struktur dargestellt.
In diesem Fall verursacht höhere Konzentrationen von Magnesium reaktive Zentren auf RNA weniger geschützt werden, produzieren eine Kd, die Hälfte des Wertes war.
Sie habe nur Jupiters Einführung in photometrische Bestimmung der konstanten Gleichgewicht beobachtet. Sie sollten jetzt verstehen die Beziehung definiert durch das Bier-Lambert Gesetz, wie Konzentration von Absorption mit einem Spektralphotometer ermittelt und wie ein Gleichgewicht konstant mit Gleichgewichtskonzentrationen zu berechnen.
Danke fürs Zuschauen!
Subscription Required. Please recommend JoVE to your librarian.
Results
Tabelle 4 enthält die Extinktion und Konzentration Daten für Lösungen 1 – 5. Konzentrationen von Fe(SCN)2 + wurden vom ursprünglichen Konzentrationen von Fe3 + unter der Annahme, dass alle von der Fe3 + konvertiert ist Fe(SCN)2 +bestimmt. Ein großer Überschuss an SCN– wurde in Röhren 1 – 5 verwendet, um sicherzustellen, dass diese Annahme zutrifft.
Das Molarity [Fe(SCN)2 +] und Absorption sind in Abbildung 2dargestellt. Die gemessenen Extinktionen stimmen gut mit den Beerschen Gesetz.
Tabelle 5 zeigt gemessenen Extinktionen und berechneten K Werte für Rohre 6 – 9. K -Werte wurden mit der ICE-Tabelle-Methode ermittelt. Anfänglichen Reaktionspartner Konzentrationen beruhten auf der bekannten Molarities von Fe3 + und SCN– in den Reaktanten Lösungen und das Gesamtvolumen der Reaktion (10 mL). Die Gleichgewicht-Konzentration von Fe(SCN)2 + war durch trennende gemessene Extinktion durch Molares Absorptionsvermögen von Fe(SCN)2 +bestimmt. Weil alle das Produkt entstand aus der 1:1 Reaktion von Fe3 + und SCN–, entspricht die Gleichgewicht-Konzentration von Fe(SCN)2 + der verringern , der Konzentration der Edukte. Tabelle 6 zeigt den Prozess für Reagenzglas 6.
Die Gleichgewichts-konstante errechnet sich aus den Konzentrationen in der Gleichgewichts-Reihe. Für Reagenzglas 6,

Die mittlere K -Wert betrug 147 ± 11, illustrieren, dass K über den Bereich der Konzentrationen untersucht etwa konstant ist.

Abbildung 2: Liniendiagramm der Extinktion und Konzentration für Fe(SCN)2 +.
| Rohr | [Fe(SCN)2 +] (Mol/L) | Extinktion |
| 1 | 1,00 x 10– 5 | 0.10 |
| 2 | 2,00 x 10– 5 | 0,20 |
| 3 | 3.00 x 10– 5 | 0,25 |
| 4 | 4.00 x 10– 5 | 0,32 |
| 5 | 5,00 x 10– 5 | 0,42 |
Tabelle 4. Extinktion gegen Konzentrationsdaten für Fe(SCN)2 +.
| Rohr | Extinktion | K |
| 6 | 0,120 | 136 |
| 7 | 0.268 | 161 |
| 8 | 0.461 | 142 |
| 9 | 0.695 | 150 |
Tabelle 5. Extinktion Werte und berechneten K für die Reaktion von Eisen (III) mit Thiocyanat gemessen.
| [Fe3 +] (Mol/L) | [SCN–] (Mol/L) | [Fe(SCN)2 +] (Mol/L) | |
| Anfängliche | 3.57 x 10– 4 | 3.57 x 10– 4 | 0 |
| Änderung | –1.58 x 10-5 | –1.58 x 10-5 | +1.58 x 10-5 |
| Gleichgewicht | 3,41 x 10– 4 | 3,41 x 10– 4 | 1,58 x 10– 5 |
Tabelle 6. Der ICE-Tabelle, die den Prozess für Reagenzglas 6 veranschaulicht.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Die Gleichgewichts-konstante liefert nützliche Informationen über das Ausmaß, das eine Reaktion auf Formular Produkte im Laufe der Zeit weitergeht. Reaktionen mit einem großen Wert von K, viel größer als 1, bilden Produkte nahezu vollständige genügend Zeit (Abbildung 3). Reaktionen mit einem Wert von K kleiner als 1 werden zu einem bedeutenden Grad nicht nach vorne gehen. Die Gleichgewichts-Konstante dient somit als Maß für die Machbarkeit einer chemischen Reaktion.

Abbildung 3. Die konstante Gleichgewicht dieser Reaktion ist größer als 1. Eine erhebliche Menge an farbigen Produkt bildet in jedem Fall, auch wenn die anfängliche Konzentrationen der Reaktanden unterscheiden.
Die Gleichgewichts-konstante bietet auch thermodynamische Wissenswertes rund um die Änderungen in freie Energie, Enthalpie und Entropie im Verlauf einer chemischen Reaktion. Die Gleichgewichts-konstante bezieht sich auf die freie Energie-Änderung der Reaktion:

Die freie Energie-Änderung der Reaktion bezieht sich wiederum auf die Enthalpie und Entropie Veränderungen der Reaktion:

Messungen der Temperaturabhängigkeit von K können zeigen, die Enthalpie Änderung ΔH und die EntropieS Δ für eine Reaktion ändern. Neben der Bereitstellung von Chemikern mit Einblick in die Muster in molekulare Verhalten, können Tabellen der thermodynamischen Daten zur Reaktionen mit günstigen thermodynamischen Eigenschaften zu identifizieren. Redox-Reaktionen, die große Mengen an Energie (verbunden mit negativen ΔG -Werte) zu veröffentlichen sind beispielsweise attraktive Kandidaten für Batterien.
Werte von K für Säure Dissoziation Reaktionen(KWerte) eignen sich für die Vorhersage der Ergebnisse der Säure-Base-Reaktionen, die thermodynamisch gesteuert werden. Starke Säuren sind große Keinen Werten und schwache Säuren mit kleinen Keinen Werten zugeordnet. pH-Indikatoren sind schwache Säuren mit unterschiedlich gefärbten saure und basische Formen und die pKeine (negative Basis 10 Logarithmus der Kein) der Indikator stellt des pH-Wertes, bei dem eine Farbveränderung tritt als eine Säure oder Base wird hinzugefügt, um eine Lösung des Indikators.
Ebenso sind KWerte bei der Herstellung von Pufferlösungen verwendet, um ein Ziel-pH-Wert zu erreichen. Die pKeine schwache Säure ist den pH-Wert, bei dem die Säure und seine Basis konjugiert in die Lösung in gleicher Konzentration vorhanden sind. Wenn gleiche Mengen von einer schwachen Säure und ihre konjugierte Base sind in einer Lösung aufgelöst, der pH-Wert der Lösung entspricht der pKeine schwache Säure.
Subscription Required. Please recommend JoVE to your librarian.




