Overview
资料来源: 实验室的迈克尔 · 埃文斯博士 — — 乔治亚理工学院
平衡常数, K,化学系统比产品浓度与反应物浓度处于平衡状态,每个他们各自的化学计量系数的幂。测量K涉及这些系统在化学平衡中的浓度测定。
反应系统包含单个颜色的组件可以分光光度法进行了研究。吸光度与浓度为彩色的组件之间的关系是测量和用来确定其感兴趣的反应体系中的浓度。可以间接使用平衡的化学方程式和彩色成分的实测的浓度计算中的无色组分浓度。
在这个视频中,啤酒的规律曲线为 Fe(SCN)2 +是根据经验来确定和应用于测量K为以下反应:
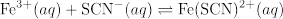
与反应物的不同初始浓度的四种反应系统进行调查,说明, K不论初始浓度恒定。
Principles
每一个化学反应是与平衡常数K,反映了产品浓度对化学平衡反应物浓度的比例。为泛型反应A + b B  c C + d D,平衡常数定义为
c C + d D,平衡常数定义为

等式的右边浓度在哪里 molarities 处于平衡状态。这个等式被称为反应的平衡表达式。在不处于平衡状态的化学系统,直到反应物浓度的正向和反向的反应发生在不同的利率和产品满足平衡表达式。
测量系统在化学平衡中K的值,就必须确定的反应物和产物的浓度,直接或间接地。K的测定分光光度法方法涉及一个彩色成分的浓度直接测量和间接测量量的其他人。在已知浓度的彩色组件的可见光谱揭示了吸光度与浓度为此组件之间的关系。啤酒的法律规定,这种关系具有形式

其中 e 是光的 L / mol-厘米, l中组分的摩尔吸光系数是光的路径长度通过厘米, c中的示例是光的在 mol / L 时,组件的摩尔浓度, A是光的吸光度。
啤酒的规律曲线为彩色组件可以应用于反应平衡的系统中来确定此组件从吸光度测量 (图 1) 的浓度。然后可以通过调整基于彩色物种实测的摩尔浓度的初始浓度计算剩余的反应物和产物的浓度。
在这里所研究的系统是与硫氰酸盐阴离子形成复杂铁 (III) 硫氰酸铁 (III) 阳离子的反应。

该反应体系的平衡表达式是

其中情商下标表示平衡浓度。铁 (III) 硫氰酸盐产品是橙色的但这两种反应物在水溶液中无色。因此,可以直接从吸光度测量确定 [Fe(SCN)2 +]情商。

反应物的平衡浓度可以减去产品从反应物初始浓度的平衡浓度计算。初始变化平衡 (ICE) 表说明了初始和平衡浓度如何相关 (表 1)。

反复的试验,但这个实验涉及不同反应物初始浓度的应产生相同的值的K, K的值是独立的浓度。

图 1。铁 (III) 硫氰酸盐的啤酒的规律曲线。
| Fe3 + | SCN- | Fe(SCN)2 + | |
| 初始 | [Fe3 +]我 | [SCN-]我 | 0 |
| 变化 | –[Fe(SCN)2 +]情商 | –[Fe(SCN)2 +]情商 | +[Fe(SCN)2 +]情商 |
| 平衡 | [Fe3 +]我— — [Fe(SCN)2 +]情商 | [SCN-]我— — [Fe(SCN)2 +]情商 | [Fe(SCN)2 +]情商 |
表 1。说明如何初始和平衡浓度等相关初始变化平衡 (ICE) 表。
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1.确定为 Fe(SCN)2 +啤酒法曲线
- 校准可见分光光度计使用蒸馏水作为一片空白。
- 将 1.0 毫升的 1.0 × 10-4 M Fe(NO3)3解决方案添加到试管。
- 对相同的试管中,加入 0.50 M 氰酸溶液 5.0 mL。
- 对相同的试管中,加入 0.10 M HNO3溶液 4.0 mL。盖住管用戴着手套的手指,轻轻摇动混合。
- 使用巴斯德吸管将转移到试管的少量的解决方案。确保液面上方光束分光光度计的路径。
- 在分光光度计,所以光线穿过透明双方试管的地方。
- 获得谱和记录的 λ 的最大值和在 λ最大吸光度。
- 构建啤酒规律曲线,用已知浓度的 Fe(SCN)2 +附加解决方案必须编写和测量。重复步骤 2-7 使用的铁 (没有3)3、 氰酸,卷和表 2中的 HNO3解决方案。
- 绘制测量吸光度与浓度的 Fe(SCN)2 +在每个试管中,确定最适合的数据线。这条线的斜率是摩尔吸光系数和路径长度是 1 厘米。
2.测量K铁 (III) 硫氰酸盐系统
- 准备 4 中等试管包含指定的卷的 0.0025 M Fe (没有3)3、 0.0025 M 氰酸和 0.10 M HNO3解决方案在表 3中。
- 涵盖每个管的一根手指,轻轻摇动混合。让他们可以至少 10 分钟。这休息期间确保解决方案是处于化学平衡状态。
- 使用巴斯德吸管将转移到试管的解决方案 6 小数量。确保液面上方光束分光光度计的路径。
- 获得谱和记录的 λ 的最大值和在 λ最大吸光度。
- 多个反应的反应物的不同初始浓度进行研究,以说明K不依赖于浓度。要为不同的初始条件确定K ,请重复步骤 3 和 4 为解决方案 7 – 9。
| 管数 | 卷 1.0 x 10-4 M Fe (没有3)3 (毫升) |
卷 0.50 M 氰酸 (毫升) |
卷 0.10 M HNO3 (毫升) |
| 1 | 1.0 | 5.0 | 4.0 |
| 2 | 2.0 | 5.0 | 3.0 |
| 3 | 3.0 | 5.0 | 2.0 |
| 4 | 4.0 | 5.0 | 1.0 |
| 5 | 5.0 | 5.0 | 0.0 |
表 2。适当的 Fe (没有3)3、 氰酸与亚硝酸卷3解决方案放在管 2-5。
| 管数 | 卷 0.0025 M Fe (没有3)3 (毫升) |
卷 0.0025 M 氰酸 (毫升) |
卷 0.10 M HNO3 (毫升) |
| 6 | 1.0 | 1.0 | 5.0 |
| 7 | 1.0 | 2.0 | 4.0 |
| 8 | 2.0 | 2.0 | 3.0 |
| 9 | 2.0 | 3.0 | 2.0 |
表 3。适当的卷的 0.0025 M Fe (没有3)3、 0.0025 M 氰酸和 0.10 M HNO3解决方案。
确定一种化学反应的平衡常数可以提供多大程度上会形成有关的重要信息产品随着时间的推移。
每一个化学反应是与平衡常数,K,反映了产品和反应物的浓度比时的反应已停止进展。测量 K,必须确定这些浓度。
如果反应包含彩色的单个组件,可以测量及其与光相互作用来辨别它的浓度。然后可以使用间接平衡的化学方程式计算无色组分浓度。此视频将说明用分光光度计进行了实证确定铁 thiocyanante 反应的平衡常数。
最化学反应进行正向和反向方向。随着反应的进行,它到达的正向和反向的反应发生速度相同点。这就是所谓的化学平衡。在这种稳定状态,产物浓度对反应物的浓度,每一次幂的他们的化学计量系数,比对应的平衡常数,k。到措施 K 系统感兴趣的应该知道系数,和必须测定浓度,直接或间接地。啤酒-兰伯特依法有色物质的浓度成正比其吸光度,这是它吸收特定波长的光的能量。这可以表示数学上, A在哪里吸光度,ε 是摩尔的衰减系数,即复合专用, l是通过样品,路径长度, c浓度。校准曲线是通过测试的已知浓度的多个解决方案并策划结果的吸光度值创建的。与此校准曲线,可以研究未知浓度的解决方案。吸光度测量用来确定有色物质的浓度。然后,可以计算剩余的反应物和产物的浓度。下面的过程将研究铁三与硫氰酸盐,形成复杂的铁硫氰酸反应。
一旦确定了浓度,值为 K 可以用初始变化平衡或冰,计算表,将在结果中进一步说明。
既然您已了解如何分光光度法可以用于确定平衡常数,你准备好开始的过程。
测量样品之前, 必须生成的校准曲线。
若要开始,零紫外-可见分光光度计使用蒸馏水作为一片空白,代表没有吸光度。当插入时试管分光光度计,确保它是面向,所以光线穿过透明的边,和液体的水平是高于束的路径。
然后,准备 5 试管包含文本的协议,这将产生不同浓度的产品所示每个反应液的指示的卷。涵盖每个管子用戴着手套的手指,并轻轻摇动混合。允许管休息 10 分钟使用巴斯德吸管将少量的解决方案 1 转、 试管、 并将其放置在分光光度计。获得谱并记录 λ 最大和其吸光度。解决方案 2-5,使用新的试管每次运行重复此过程。
绘制测量吸光度与浓度的铁硫氰酸盐为每个解决方案。确定最适合的数据线。这条线的斜率是摩尔的衰减系数。
现在取得的数据为标准的解决方案,准备四中等试管包含解决方案的指示的卷文本协议中所示。
涵盖每个管的一根手指,轻轻摇动混合。让他们可以至少 10 分钟。此休息期间允许要达到化学平衡的解决方案。
使用巴斯德吸管将传输解决方案 6 小数量到试管,并将其放置在分光光度计。获得谱并记录 λ 最大值和吸光度测量 λ 最大。为解决方案 7 – 9 重复此过程。
一旦所有的样品进行了测量,可以分析解决方案 1-5 的摩尔浓度和吸光度数据。过量的硫氰酸盐用来确保所有的铁反应,从而简化了分析。
绘制数据创建校准曲线。光的路径长度 l,通常是 1 厘米,和可以不计入。因此,线,计算了要 7600,坡是衰减系数。测试解决方案 6-9,此值和吸光度用于计算铁硫氰酸盐浓度处于平衡状态。与这一数据,然后可以利用冰桌。
反应物初始浓度基于已知的 molarities 的铁和硫氰酸盐添加到解决方案,以及反应的总量。由于该产品由铁和硫氰酸盐的 1:1 反应,平衡浓度的每个产品的数量减少形成。现在已知每个物种的平衡浓度。使用这些值来计算每个解决方案的平衡常数。和值基本恒定,浓度进行了研究的范围内。
平衡常数的概念是重要的科学领域种类繁多。平衡常数可以用于提供有用的信息的反应将形成的程度随着时间的推移产品。在此示例中,观察到两种含结晶紫的反应。
第一个解决方案被由结晶紫和氢氧化钠。观察到的颜色迅速从紫色变成无色。这种反应有很大的 K 值,该值指示产品形成几乎完全地随着时间的推移。
然后与醋酸钠反应结晶紫。此解决方案无限期地保持紫色。这种反应有一个非常低的 K 值,所以它并不进行很大程度上向前。
最后,解离常数 — — 特定类型的平衡常数 — — 可以用来描述蛋白质行为。在此示例中,RNA 的结构变化进行监测镁反应缓冲区中。
纯化的 RNA 是用已知浓度的镁,混合成溶液和允许达到平衡。然后,生成的 RNA 结构,绘制。
在这种情况下,高浓度的镁引起反应活性部位对 RNA 得到的保护,生产了一半价值 Kd。
你刚看了朱庇特的简介分光光度法测定的平衡常数。现在,您应该了解定义由啤酒 — 朗伯定律、 如何确定从吸光度用分光光度计,浓度和如何计算使用平衡浓度平衡常数的关系。
谢谢观赏 !
Subscription Required. Please recommend JoVE to your librarian.
Results
表 4列出解决方案 1-5 的浓度和吸光度数据。从初始浓度的 Fe3 +的 Fe3 +所有转换为 Fe(SCN)2 +的假设下测定了 Fe(SCN)2 +的浓度。大量过剩的 SCN-用于在管 1 — — 5 确保这种假设是如此。
摩尔浓度 [Fe(SCN)2 +] 和吸光度,绘制在图 2中。测得的吸光度与啤酒的法律一致。
表 5列出了测得的吸光度值和计算的K值管 6 – 9。使用冰表法,测定了K值。初始反应物浓度基于已知的 molarities 的 Fe3 +和 SCN-反应物溶液中和反应 (10 毫升) 的总量。划分测得的吸光度测定平衡浓度的 Fe(SCN)2 +了 Fe(SCN)2 +的摩尔吸光系数。因为所有的产品形成从 1:1 反应的 Fe3 +和 SCN-,平衡浓度的 Fe(SCN)2 +对应于减少反应物浓度。表 6显示试管 6 的过程。
从平衡行中浓度计算平衡常数。测试管 6,

平均K值为 147 ± 11,说明K大致恒定浓度进行了研究的范围。

图 2。线图的吸光度与浓度为 Fe(SCN)2 +.
| 管 | [Fe(SCN)2 +](mol/L) | 吸光度 |
| 1 | 1.00 x 10-5 | 0.10 |
| 2 | 2.00 x 10-5 | 0.20 |
| 3 | x 10– 5 3.00 | 0.25 |
| 4 | x 10-5 4.00 | 0.32 |
| 5 | 5.00 x 10-5 | 0.42 |
表 4。吸光度与浓度数据为 Fe(SCN)2 +.
| 管 | 吸光度 | K |
| 6 | 0.120 | 136 |
| 7 | 0.268 | 161 |
| 8 | 0.461 | 142 |
| 9 | 0.695 | 150 |
表 5。测定吸光度值和计算的 K 为铁 (III) 与硫氰酸盐反应。
| [Fe3 +](mol/L) | [SCN-](mol/L) | [Fe(SCN)2 +](mol/L) | |
| 初始 | 3.57 x 10-4 | 3.57 x 10-4 | 0 |
| 变化 | –1.58 x 10-5 | –1.58 x 10-5 | +1.58 x 10-5 |
| 平衡 | 3.41 x 10-4 | 3.41 x 10-4 | 1.58 x 10-5 |
表 6。冰表,说明了用于试管 6 的过程。
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
平衡常数提供有用的信息的反应将前往形式产品随着时间的推移的程度。反应值大的K,远远大于 1,将形成产品几乎完全有足够的时间 (图 3)。一个值K小于 1 的反应将不继续前进在很大程度。平衡常数可作为一种化学反应的可行性措施。

图 3。这种反应的平衡常数大于 1。大量的彩色产品形式,在每种情况下,即使反应物初始浓度不同。
平衡常数也提供有用的热力学信息对自由能源、 焓和熵在化学反应过程中的变化。平衡常数与反应的自由能变化有关:

反应的自由能变化反过来相关反应的焓和熵的变化:

K的温度依赖性的测量可以显示焓变化 ΔH和熵变化 ΔS的反应。除了提供洞察分子行为中的模式的化学家,表的热力学数据可以用于标识反应与良好的热力学性能。例如,释放大量 (与消极 ΔG值关联) 的氧化还原反应是能量的具有吸引力的电池。
酸解反应 (K值) 的K值可用于预测的酸-碱反应,热力学控制结果。强酸是与大K值和弱酸与小K值相关联。ph 值指标是弱酸与不同颜色的酸性和碱性的形式,和 pK ( K负基地 10 对数) 的指标表示的 ph 值,作为一种酸发生颜色变化或基地添加到指示器的解决方案。
同样, K值用于在缓冲溶液的制备中实现目标的 pH 值。在其中的酸和它的共轭碱存在于溶液中,相同的浓度的 ph 值表示 pK的一种弱酸。当相同数量的一种弱酸及其共轭碱溶解在溶液中,溶液的 ph 值等于 pK的弱酸。
Subscription Required. Please recommend JoVE to your librarian.




