Overview
Fuente: Laboratorio del Dr. Jimmy Franco - Merrimack College
La recristalización es una técnica utilizada para purificar compuestos sólidos. 1 sólidos tienden a ser más soluble en líquidos calientes que en líquidos fríos. Durante la recristalización, un compuesto sólido impuro se disuelve en un líquido caliente hasta que la solución está saturada, y entonces el líquido se deja enfriar. 2 el compuesto entonces debe formar cristales relativamente puros. Idealmente, las impurezas que están presentes se mantendrá en la solución y no se incorporarán a los cristales crecientes (figura 1). Los cristales pueden eliminarse luego de la solución por filtración. No todo el compuesto es recuperable, algunos permanecerán en la solución y se perderán.
La recristalización no es considerada como una técnica de separación; por el contrario, es una técnica de purificación en el que se elimina una pequeña cantidad de una impureza de un compuesto. Sin embargo, si las propiedades de solubilidad de dos compuestos son lo suficientemente diferentes, la recristalización puede utilizarse para separarlas, aunque están presentes en cantidades casi iguales. Recristalización funciona mejor cuando la mayoría de las impurezas ya se han quitado por otro método, como extracción o columna cromatografía.
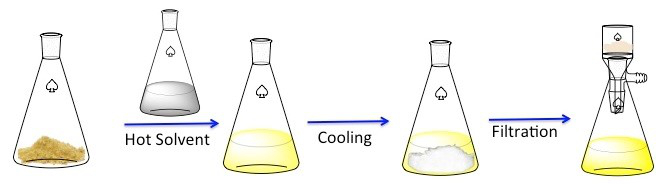
Figura 1. El esquema general para recristalización.
Principles
Una recristalización acertada depende de la elección adecuada del disolvente. El compuesto debe ser soluble en el solvente caliente e insoluble en el solvente mismo cuando hace frío. A los efectos de la recristalización, tener en cuenta 3% w/v la línea divisoria entre soluble e insoluble: Si 3 g de un compuesto se disuelve en 100 mL de un solvente, se considera soluble. En la elección de un disolvente, mayor será la diferencia entre solubilidad en caliente y frío solubilidad, el producto más recuperable de recristalización.
La tasa de enfriamiento determina el tamaño y la calidad de los cristales: enfriamiento rápido favorece pequeños cristales, y enfriamiento lento favorece el crecimiento de cristales grandes y generalmente más puros. La velocidad de recristalización es generalmente mayor a unos 50 ° C por debajo del punto de fusión de la sustancia; la máxima formación de cristales se produce a unos 100 ° C por debajo del punto de fusión.
Aunque los términos "cristalización" y "recristalización" a veces se usan indistintamente, técnicamente se refieren a diferentes procesos. Cristalización se refiere a la formación de un nuevo producto insoluble de una reacción química; Este producto entonces se precipita de la solución de reacción como un sólido amorfo que contiene muchas impurezas atrapadas. La recristalización no implica una reacción química; el producto crudo simplemente se disuelve en solución, y luego se cambian las condiciones para permitir que los cristales se vuelven a formar. Recristalización produce un producto final más puro. Por esta razón, los procedimientos experimentales que producen un producto sólido por cristalización normalmente incluyen un paso final de recristalización para dar el compuesto puro.
Procedure
Realizar todos los pasos en una campana de humos para evitar la exposición a los vapores de disolvente.
1. selección de un solvente
- Coloque 50 mg de la muestra (N-bromosuccinimide) en un matraz Erlenmeyer.
- Agregar 0,5 mL de solvente (agua) que hierve. Si la muestra se disuelva por completo, la solubilidad en el solvente frío es demasiado alta para ser un solvente de recristalización buena.
- Si la muestra no se disuelve en el solvente frío, calentar el tubo de ensayo hasta que el solvente se reduce.
- Si la muestra no se disuelve completamente en este punto, añadir más solvente punto de ebullición mediante goteo, hasta que todo el sólido se disuelva. Si toma más de 3 mL para disolver la muestra en el solvente caliente, la solubilidad en este solvente es probablemente demasiado baja para que sea un disolvente de recristalización buena.
- Si la primera opción del disolvente no es un solvente de recristalización buena, probar con otros. Si no encuentra un disolvente único que funciona, probar con un sistema solvente dos.
- Si no puede encontrar un solo sistema solvente adecuado, un par de solvente puede ser necesario. Hora de identificar una pareja solvente, hay varias consideraciones claves 1) el primer solvente fácilmente debe disolver el sólido. 2) el segundo solvente debe ser miscible con el disolvente dest 1, pero tiene una solubilidad mucho más baja para el soluto.
- Como regla general "como disolver le gusta" lo que significa que los compuestos polares tienden a ser solubles en solventes polares y no polares compuestos suelen ser más solubles compuestos no polares.
- Pares de disolvente común (tabla 1)
- Asegúrese de que el disolvente tiene un punto de ebullición de al menos 40 ° C, por lo que hay una diferencia de temperatura razonable entre solvente y disolvente de la temperatura de ebullición.
- Asegúrese de que el solvente tiene un punto de ebullición por debajo de 120 ° C, por lo que es más fácil eliminar los últimos restos de solvente de los cristales.
- También asegúrese de que el punto de ebullición del solvente es menor que el punto de fusión del compuesto, por lo que el compuesto forma cristales sólidos en lugar de un aceite insoluble.
- Confirmar que las impurezas sean insolubles en el solvente caliente (para que puedan ser filtradas hacia fuera, una vez que se disuelve el compuesto) o soluble en el solvente frío (por lo que permanecen disueltos durante todo el proceso).
2. disolver la muestra en el solvente caliente
- Coloque el compuesto a ser recristalizado en un matraz Erlenmeyer. Se trata de una opción mejor que un vaso de precipitados, ya que los lados inclinados ayudar a vapores de solventes de trampa y retardar la velocidad de evaporación.
- Coloque el solvente (agua) en un matraz de Erlenmeyer aparte y agregar chips hirviendo o una barra de agitación para mantenerlo hirviendo suavemente. Calentar a ebullición sobre una placa.
- Añadir solvente caliente a un matraz a temperatura ambiente que contiene el compuesto en pequeñas porciones, se arremolinan después de cada adición, hasta que el compuesto se disuelva completamente.
- Durante el proceso de disolución, mantener la solución caliente en todo momento descansando sobre la placa, también. No agregue más caliente solvente del necesario - lo suficiente para disolver la muestra.
- Si una porción del sólido parece no disolverse, incluso después de añadir más solvente caliente, es probable debido a la presencia de impurezas muy insolubles. Si esto sucede, dejar de agregar solvente y hacer una filtración caliente antes de proceder.
- Para realizar una filtración caliente, doblar un trozo de papel de filtro en forma de cono acanalado y lo coloca en un embudo sin tallo de cristal.
- Añadir un exceso de 10-20% de disolvente caliente a la solución caliente para permitir la evaporación en el procedimiento.
- Verter la solución a través del papel. Si los cristales se empiezan a formar en cualquier momento durante el proceso, agregar una pequeña porción del solvente caliente para disolverlas.
3. enfriamiento de la solución
- Coloque el frasco que contiene el compuesto disuelto en una superficie que no conducen el calor lejos demasiado rápido, tal como una toalla de papel en un banco.
- Cubra ligeramente el matraz como se enfría para evitar la evaporación y evitar que el polvo caiga en la solución.
- Deje reposar el frasco hasta que se enfríe a temperatura ambiente.
- Una vez que los cristales se han formado, colocar la solución en un baño de hielo para asegurar que se obtiene la máxima cantidad de cristales. Las soluciones deben dejarse imperturbadas en el baño de hielo durante 30 min a 1 h, o hasta que el compuesto parece haber totalmente cristalizada de la solución.
- Si no hay formación de cristales es evidente, puede ser inducida por rayar el interior las paredes del matraz con una varilla de vidrio o mediante la adición de un cristal de la pequeña semilla del mismo compuesto.
- Si esto todavía no funciona, entonces demasiado solvente fue utilizada probablemente. Recaliente la solución, permitir que algunos del solvente a hervir apagado, luego enfriarlo.
4. aislar y secar los cristales
- Coloque el matraz frío que contiene el recién formados cristales en un banco.
- Cubra ligeramente el frasco para evitar la evaporación y evitar que el polvo caiga en la solución.
- Aislar los cristales por filtración de vacío, utilizando embudo de Hirsch o Büchner (abrazadera el matraz a un anillo de soporte de primera).
- Lave los cristales en el embudo Büchner con una pequeña cantidad de disolvente fresco, frío (el mismo disolvente utilizado para recristalización) para eliminar las impurezas que pueden pegarse a los cristales.
- Para secar los cristales, deja en el embudo de filtro y jalar aire a través de ellos durante varios minutos. Cristales pueden también ser secadas al aire por lo que les permite reposar destapado varias horas o días. Más eficientes métodos incluyen secado al vacío o colocar en un desecador.
| Solvente polar | Menos solvente Polar |
| Acetato de etilo | Hexano |
| Metanol | Cloruro de metileno |
| Agua | Etanol |
| Tolueno | Hexano |
Tabla 1. Pares de disolventes comunes.
La recristalización es una técnica de purificación de compuestos sólidos.
Para realizar la recristalización, un compuesto sólido impuro se mezcla con el solvente caliente para formar una solución saturada. Como esta solución se enfría, la solubilidad del compuesto disminuye y puros cristales crecen de la solución.
Recristalización a menudo se utiliza como paso final después de otros métodos de separación como la extracción, o cromatografía en columna. Recristalización puede utilizarse también para separar dos compuestos con propiedades de solubilidad diferentes. Este video ilustra la selección solvente para recristalización, purificación de un compuesto orgánico de la solución y presentará un número de aplicaciones en química.
Cristalización comienza con la nucleación. Las moléculas de soluto vienen juntos para formar un pequeño cristal estable, que es seguido por crecimiento de cristales. Nucleation ocurre más rápido en los sitios de nucleación como cristales de semilla, arañazos o impurezas sólidas que espontáneamente en solución. Agitación también puede favorecer la nucleación rápida. Sin embargo, el rápido crecimiento puede llevar a incorporación de impurezas si no se cultiva en óptimas condiciones.
La solubilidad de un compuesto tiende a aumentar con la temperatura y es altamente dependiente de la elección del disolvente. Cuanto mayor sea la diferencia de solubilidad a temperatura alta y baja, más probable es para que el soluto salir de la solución se enfría y forma cristales.
El solvente elegido debe tener un punto de ebullición de al menos 40 ° C por lo que hay una diferencia de temperatura significativa entre ebullición y temperatura. Punto de ebullición del disolvente también debe ser por debajo del punto de fusión del soluto para permitir la cristalización. Enfriamiento rápido de la solución induce la formación de muchos sitios de nucleación, por lo tanto favorece el crecimiento de muchos pequeños cristales. Sin embargo, el enfriamiento lento induce la formación de menos sitios de nucleación y favorece los cristales más grandes y más puros. Así, el enfriamiento lento se prefiere.
Además, se puede seleccionar un disolvente para minimizar las impurezas. Si una impureza de la solución es más soluble que el soluto sí mismo, se puede lavar apagado los completamente formados cristales con solvente frío. Sin embargo, si una impureza es menos soluble, a cristalizar primero y luego pueden filtrarse fuera de la solución caliente, antes de la recristalización del soluto.
Si no hay solvente solo tiene las propiedades necesarias, puede utilizarse una mezcla de solventes. Para una pareja solvente, el solvente primer fácilmente debe disolver el sólido. El segundo solvente debe tener una solubilidad más baja para el soluto y ser miscible con el solvente de la primera. Pares de disolventes comunes incluyen acetato de etilo y hexano, tolueno y hexano, metanol y diclorometano y agua y etanol.
Ahora que usted entiende los principios de la recristalización, vamos a ir a través de un procedimiento para la purificación de un compuesto orgánico por recristalización.
Para comenzar este procedimiento, colocar 50 mg de la muestra en un tubo de vidrio.
Agregar 0,5 mL de disolvente de la temperatura ambiente. Si el compuesto se disuelva por completo, la solubilidad en el solvente frío es demasiado alta para la recristalización. De lo contrario, calienta la mezcla en el tubo de ensayo hasta que hierva.
Si el compuesto no se disuelve completamente en el solvente hirviendo, caliente otra porción de disolvente a ebullición. Agregue el solvente hirviendo gota a gota al tubo de ensayo hasta que el sólido se disuelva totalmente o hasta que el tubo de ensayo contiene 3 mL de solvente. Si todavía no se disuelve el sólido, su solubilidad en este disolvente es demasiado baja.
Confirman que las impurezas insolubles en el solvente caliente por lo que se pueden filtrar hacia fuera después de la disolución o solubilidad en el solvente frío por lo que permanecen en solución después de la recristalización es completa. Si un solvente cumple todos los criterios, es adecuado para la recristalización.
Para iniciar la recristalización, calentar el disolvente a ebullición sobre una placa caliente en un matraz de Erlenmeyer con una barra de agitación. Coloque el compuesto a ser recristalizado en otro erlenmeyer a temperatura ambiente.
A continuación, agregue una pequeña porción del solvente caliente al compuesto. Agitar la mezcla en el frasco y luego la coloque sobre la placa. Repita este proceso hasta que la muestra se haya disuelto totalmente o hasta que la adición de disolvente no provoca ninguna disolución más.
Añadir un exceso de 10% de disolvente caliente a la solución para tener en cuenta para la evaporación. Coloque papel de filtro en una configuración de embudo Büchner. Filtrar la solución para eliminar las impurezas insolubles. Si los cristales se forman durante la filtración, disolverlas con gotas del solvente caliente.
Enfríe la solución en la mesa. Cubrir el matraz para evitar la pérdida de solvente por evaporación y para mantener las partículas fuera de la solución.
Deje reposar el frasco hasta que se enfríe a temperatura ambiente. Agitación durante el enfriamiento puede causar cristalización rápida, produciendo cristales menos puros. Si no hay formación de cristales es evidente al enfriamiento, inducir cristalización rasguñando suavemente el interior las paredes del matraz con una varilla de vidrio o agregar un cristal de la pequeña semilla del compuesto está recristalizado.
Si no induce formación de cristales, calentar la solución a hervir algunos del solvente y luego enfriar el solvente a temperatura ambiente una vez más.
Una vez se han formado cristales, prepare un baño de hielo. Mantener la solución de cubierta, enfriar la solución en el baño de hielo hasta cristalización parece ser completa.
Un matraz de filtración en un soporte de anillo de la abrazadera y conectar el matraz a una línea de vacío. Establecer un embudo Büchner y el adaptador en la boca del matraz.
Vierta la mezcla de la solución y cristales en el embudo y comience la filtración de vacío. Enjuagar los cristales restantes en el frasco en el embudo con el disolvente frío. Lave los cristales en el embudo con solvente frío para remover impurezas solubles.
Continuar dibujando el aire a través del embudo para secar los cristales y luego apague la bomba de vacío. Si es necesario, los cristales pueden poder reposar a temperatura ambiente al aire seco o colocado en un desecador antes de guardar el sólido cristalizado.
Se han eliminado las impurezas amarillo presentes en el compuesto crudo, produciendo un sólido grisáceo. Basado en la identidad de los compuestos y las impurezas, la pureza de los cristales puede ser verificada por espectroscopia NMR, las mediciones de punto de fusión o inspección visual.
Purificación por recristalización es una herramienta importante para el análisis y síntesis química.
Cristalografía de la radiografía es una técnica de caracterización de gran alcance que identifica la estructura atómica tridimensional de una molécula. Esto requiere de un solo cristal puro, que se obtiene por recristalización. Algunas clases de moléculas como las proteínas son difíciles de cristalizar, pero sus estructuras son extremadamente importantes para la comprensión de sus funciones químicas. Con una cuidadosa selección de las condiciones de la recristalización, incluso estas clases de moléculas pueden ser analizadas por cristalografía de rayos x. Para más información sobre este proceso, ver vídeo de la colección en el crecimiento de cristales para la cristalografía.
Reactivos impuros pueden causar reacciones secundarias no deseadas. Reactivos de la purificación por recristalización mejora el rendimiento y pureza del producto. Una vez que un producto sólido ha sido aislado y lavada, rendimiento de reacción puede incrementarse por eliminación de volátiles del filtrado y recristalización del producto del sólido resultante. Proteínas del anticongelante, o AFP, se expresa en muchos organismos que viven en ambientes gélidos. AFP obstaculizan el crecimiento de hielo interno atando a aviones, inhibir la recristalización en cristales de hielo más grandes del hielo. Diferentes AFPs se unen a diferentes tipos de aviones de cristal de hielo. Investigar mecanismos vinculantes de AFP implica adsorción en cristales de hielo solo. Correcto crecimiento de un cristal de hielo solo es esencial para obtener resultados claros e informativos. Estas proteínas tienen aplicaciones de la ingeniería de cultivos resistentes a frío criocirugía.
Sólo ha visto la introducción de Zeus a compuestos de la purificación por recristalización. Ahora debe estar familiarizado con los principios de la técnica, un procedimiento de purificación y algunas aplicaciones de la recristalización en química.
¡Gracias por ver!
Results
En la figura 2se muestra un ejemplo de los resultados de la recristalización. Se han eliminado las impurezas amarillo presentes en el compuesto crudo, y el producto puro queda como un sólido blanco. La pureza del compuesto recristalizada ahora puede ser verificada por la espectroscopia de resonancia magnética nuclear (RMN) o, si se trata de un compuesto con un punto de fusión publicado, por lo parecido su punto de fusión es el punto de fusión de la literatura. Si es necesario, pueden realizarse múltiples recristalizaciones hasta que la pureza es aceptablemente alta.

Figura 2. 2a) un 2b (izquierda), compuesto crudo) recristalizado producto antes de filtración (medio) y 2 c) el mismo compuesto después de la recristalización (derecha).
Applications and Summary
La recristalización es un método de purificación de un compuesto mediante la eliminación de las impurezas que podrían mezclarse con él. Funciona mejor cuando el compuesto es muy soluble en un disolvente caliente, pero muy insolubles en la versión fría del mismo disolvente. El compuesto debe ser un sólido a temperatura ambiente. Recristalización se utiliza a menudo como un paso final de limpieza, después de otros métodos (tales como cromatografía extracción o columna) que son eficaces en la eliminación de grandes cantidades de impurezas, pero que no suba la pureza del compuesto final a un nivel suficientemente alto.
La recristalización es la única técnica que puede producir monocristales absolutamente puros y perfectos de un compuesto. Estos cristales pueden utilizarse para análisis de rayos x, que es la máxima autoridad en la determinación de la estructura y la forma tridimensional de una molécula. En estos casos, la recristalización puede proceder muy lentamente, a lo largo de semanas o meses, para permitir que el enrejado cristalino para formar sin la inclusión de impurezas. Vidrio especial es necesario para permitir que el solvente se evapora tan lentamente como sea posible durante este tiempo, o dejar que el disolvente se mezcla con otro disolvente en el que el compuesto es insoluble (llamado adición antisolvent) muy lentamente.
La industria farmacéutica también hace uso pesado de recristalización, ya que es un medio de purificación más fácilmente escalar de cromatografía en columna. 3 la importancia de la recristalización en aplicaciones industriales ha desencadenado educadores para enfatizar la recristalización en el plan de estudios de laboratorio. 4 por ejemplo, el medicamento Stavudine, que se utiliza para reducir los efectos del VIH, se aísla normalmente por cristalización. 5 a menudo, las moléculas tienen estructuras múltiples de cristal diferentes disponibles, por lo que es necesario para la investigación evaluar y entender que forma cristalina se aísla en qué condiciones, tales como el enfriamiento tipo, composición solvente y así sucesivamente. Estas formas diferentes de cristal podrían tener propiedades biológicas diferentes o sean absorbidas por el cuerpo a diferentes velocidades.
Un uso más común de recristalización es en la fabricación del caramelo de la roca. Caramelo de la roca se hace disolviendo azúcar en agua caliente hasta el punto de saturación. Palillos de madera se colocan en la solución y la solución se permite refrescar y se evaporan lentamente. Después de varios días, cristales grandes de azúcar han crecido en todo los palillos de madera.
References
- Mayo, D. W.; Pike, R. M.; Forbes, D. C., Microscale organic laboratory : with multistep and multiscale syntheses. 5th ed.; J. Wiley & Sons: Hoboken, NJ, p xxi, 681 p (2011).
- Armarego, W. L. F.; Chai, C. L. L., Purification of laboratory chemicals. 5th ed.; Butterworth-Heinemann: Amsterdam ; Boston; p xv, 609 p (2003).
- Ray, P. C.; Tummanapalli, J. M. C.; Gorantla, S. R., Process for the large scale production of Stavudine. Google Patents: (2011).
- Hightower, T. R.; Heeren, J. D., Using a Simulated Industrial Setting for the Development of an Improved Solvent System for the Recrystallization of Benzoic Acid: A Student-Centered Project. Journal of Chemical Education 83 (11), 1663 (2006).
- Rohani, S.; Horne, S.; Murthy, K., Control of Product Quality in Batch Crystallization of Pharmaceuticals and Fine Chemicals. Part 1: Design of the Crystallization Process and the Effect of Solvent. Organic Process Research & Development 9 (6), 858-872 (2005).




