Overview
资料来源: 实验室的博士尼尔 · 艾布拉姆斯 — — 美国纽约州立大学环境科学与林业学院
所有的化学反应,有定义反应物去产品的进度以特定速度。这一比率可以受温度、 浓度和反应物的物理性能。该速率也包括中间体和过渡态,形成的但是既不是反应物,也不是产品。速率定律在反应中定义的每种反应物的作用,可以用于数学模型进行反应所需的时间。速率方程的一般形式如下所示:
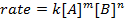
A和B都是不同的分子形态, m和n浓度反应订单, k是速率常数。几乎每个反应的速率变化随着时间的推移,随着反应物的消耗,使有效碰撞不太可能发生。然而,速率常数,任何单一的反应,在给定温度被固定。反应顺序说明了参与反应的分子物种的数量。它是非常重要的是要知道率法,包括速率常数和反应顺序,只可以通过实验确定。在这个实验中,我们将探讨一个方法为确定率法和用它来理解化学的反应的研究进展。
Principles
动力学和热力学
所有化学反应都受两个因素、 动力学和热力学。热力学因素是自由能量释放在化学反应过程中的差异。这种自由能量,称为自发性,是复杂的价值 (热) 的焓和熵 (障碍) 内的化学反应而引起。动力学是指化学反应和系统达到平衡的速度有多快的速率。虽然动力学可以解释的反应速度,热力学收益率其能量有关的信息。简单地说,涉及稳定性的热力学和动力学涉及反应性。
确定率
率是基于时间的测量,意味着它不断变化随着反应的进行。这可以使用微分速率定律,变化的时间表示浓度的变化来表示。通过实验,微分速率定律很难使用,所以我们可以使用微积分和代表率法作为综合的速率定律结合微分速率定律。综合的速率定律表示反应浓度在反应开始时和在指定的时间间隔。表的顺序、 速率定律、 综合的速率定律是如下所示:

每个订单说明反应物浓度对反应速率的依赖性。例如,零订单率定律,率 = k,显示率仅取决于反应物浓度对反应速率常数,不。这是常见的催化反应在催化剂是一种固体和反应过程中的表面面积不会改变。1st订单速率定律表明,虽然其他反应物可能存在速度依赖某一反应物的浓度。2nd订单率法指示是依赖于浓度的两种反应物的反应率。这些反应可以是相同的即率 = k[A]2,或不同,率 = k[A] [B]。由于两种浓度的不断变化,第二顺序速率常数可能很难在实验室中测量。无论命令,使用综合的速率定律简化数据分析数据,从而绘制和应用线性方程拟合数据。因为只有一个综合的速率定律将适合的数据,可以立即发现反应速率常数和反应级数。
动力学实验
确定率法始于建立化学反应动力学实验。动力学实验是严格控制,以确定一种随着时间的推移浓度的变化在一定的时间间隔进行测量。物种可以是反应物 (降低浓度与时间) 或产品 (浓度随时间增加)。如果涉及到多个反应物,它也是非常重要的只有一个反应物浓度随时间变化。其他远远高于正在研究反应物反应物浓度的增加使它显示只有一个反应物的浓度在实验过程中变化。
在这个实验中,探讨了催化过氧化氢分解的催化剂铂。铂金是一种催化剂,因为只有一个物种被涉及分解成两种产品中下面的反应:
2 H2O2(aq) → O2(g) + 2 H2O(l)
因为产品之一,O2,是一种气体,可以测量系统的压力随着时间的推移增加和理想气体定律 (PV = nRT) 用于与压力相关的痣。一旦这样做了几个不同浓度的反应物,反应顺序和率法律是可以解决的。
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1.准备 H2O2稀释
- 股票 3%的双氧水具有浓度 0.882 M.准备 5 稀释从 0.882 M 到 0.176 M (表 1)。准备这些解决方案容积大,但由于溶质是很稀,水卷是加法作准备添加剂。
- 将解决方案放在恒温水浴或离开他们在室温平衡工作台上。20-25 ° C (293-298 K) 温度范围是对这种反应很好。

表 1。H2O2使用的解决方案。
2.配制反应釜
- 想确定反应釜容积、 装满水的大测试管子的顶部和 1 孔橡胶塞插入试管直到紧和水推两侧向外和通过的顶部。
- 删除的塞子,把水倒进量筒来确定确切的水的体积。这是反应容器 (试管) 的总量。
3.测量氧气演变
- 替换的第一次的过氧化氢溶液 50 毫升水和放回入水浴。一旦平衡,添加镀铂的反作用盘和密封系统与塞子相连的气体压力传感器。这些光盘常用的隐形眼镜清洗系统。
- 一旦压力传感器安装程序以获得 2 点/秒的数据,运行实验为 120 s。游标卡尺的气体压力传感器,GPS BTA,建议对这次试验。
- 应观察气泡,如过氧化物分解为氧气和水。释放压力,处置解决方案,冲洗,然后用下过氧化氢溶液替换解决方案。重复的气体压力测量,直到所有的解决方案都经过测试。
4.数据分析
- 将所有数据文件的压力随时间都转移到电子表格程序。
- 确定初始速率-假设的过氧化氢浓度没有多少期间实验的短的时间内改变。数据表示动力学实验的初始线性的区域。
- 通过绘制压力随时间和使用坡确定边坡公式或线性回归。情节在任何共同的单位压力。
- 边坡是单位压力O2/s 的初始速率。
- 确定反应级数
- 因为进化 O2压力分解 H2O2的痣成正比,密谋 ln (初始速率) 与 ln [H2O2]0产量坡等效的顺序的反应。初始浓度,[H2O2]0,是双氧水的什么的试验,每年使用。
- 速率定律的方程是
 。以自然对数 (ln) 的方程产生一个线性方程
。以自然对数 (ln) 的方程产生一个线性方程 , m,边坡,哪里的反应顺序。
, m,边坡,哪里的反应顺序。
- 速率定律的方程是
- 因为进化 O2压力分解 H2O2的痣成正比,密谋 ln (初始速率) 与 ln [H2O2]0产量坡等效的顺序的反应。初始浓度,[H2O2]0,是双氧水的什么的试验,每年使用。
- 确定速率常数, k
- 为每个审判,转换率、 PO2/s,atm/s 单位如果率在不同的单位,如乇/s。
- 因为泡沫演化在水溶液中,减去蒸气压力的水从每个审判的系统压力。新利率反映了只造成析氧的压力。
- 应用理想气体定律摩尔/s 在每次试验从 atm/s 转换率。
- 重新排列 PV = nRT 到 n = PV/室温S-1单位保持不变。体积相当于试管体积减去溶液的体积 (50 毫升)。
- 使用平衡的化学反应从痣痣的过氧化氢分解在每次试验生产的氧气转换。
- 摩尔的 H2O2除以体积的溶液,0.050 L,产生 H2O2每秒,[H2O2] 分解的摩尔浓度 / s。
- 由于本实验遵循一阶动力学,分率,[H2O2] / s,由原来的溶液浓度为每个审判,[H2O2]0,产生速率常数, k。此解决方案为速率常数将有所不同,稍有根据先前确定的反应。
- 在一起平均速率常数为每个审判,因为温度是恒定的。
所有的化学反应,有特定的速率,它定义了如何快速反应物变成产品。
化学反应受两个因素: 动力学和热力学。热力学因素占会发生反应,如果它吸收或放出能量的过程。
动力学是指的一种化学反应,并如何快速系统达到平衡率。反应的动力学描述了动力学速率法,定义了基于反应速率常数、 组分的浓度和反应级数的速率。
这个视频将介绍反应动力学方程率法的同时,并将演示如何确定在实验室的某些反应速率定律。
一般的反应,反应速率等于速率常数时间反应物的浓度,每个增至反应级数。速率常数,k,固定在给定温度下的反应。
反应级数是独立的化学计量系数。相反他们依赖的反应机理,并说明如何率与反应物浓度有关。例如,如果反应速率不变时的"A"双打,然后反应浓度不依赖于浓度,和顺序是零。
如果率成倍增长时反应物 A 的浓度增加一倍,那么反应就是"a"的第一份订单相同的行为是如此反应物"B"。反应的总体秩序是每种反应物的个别反应订单的总和。
在反应过程中反应物浓度随时间变化。注意,基本速率方程不包括时间作为一个变量,并且可以只涉及在一特定时点的浓度分布和速度。然而,率变化的反应,以及收入随着反应物的消耗。使用微分速率定律可以涉及到时间浓度的变化。
必须通过实验,确定反应速率定律在化学反应严格控制在一个常数,测量温度和反应物或产物的浓度在特定的时间间隔。由于浓度测量是在离散的时间点,差率法很难相关的实验数据。
综合差率法结果在相对简单的方程,称为综合的速率定律。综合的速率定律将反应物浓度的反应开始时和在指定的时间进行比较。
综合的速率法方程而异的反应顺序。这些方程可以采取线性形式 y = mx + b。因此,一块浓度与时间的收益率为零阶方程的线性情节,情节浓度与时间的自然对数收益率线性情节为一个一阶方程,等等。通过拟合实验数据对这些方程,可以轻松地确定反应级数。速率常数,k,可以然后使用确定直线的斜率。最后,k 的单位而异的反应顺序。为零级反应,单位是摩尔每升每秒,为一级反应,单位为逆秒和为二级反应的单位是每摩尔每秒升。
既然已解释的动力学速率法律基本知识,让我们看看如何通过实验确定为水和氧气的过氧化氢的分解速率定律。
在这个实验中,探讨了催化过氧化氢分解的催化剂铂。
首先,准备 5 过氧化氢稀释度的如表中所示。在这种情况下,浓度范围从 0.882 — — 0.176 M,使用 3%或 0.882 M 股票解决方案。允许的解决方案,以平衡至室温。
接下来,准备使用试管反应容器。首先确定该卷由充满水的大测试管子的顶部。然后,插入 1 孔橡胶塞子,直到紧和水推钻通过顶部。
删除塞子,并把水倒进量筒测量精确的体积。这是反应釜容积。
接下来,50 毫升的第一次的过氧化氢溶液倒入试管,,然后在 25 ° C 水浴中放置管。一旦平衡,添加白金镀膜的反应光盘,和密封塞子与系统相连的气体压力传感器。
由于产品之一是氧气气体,在系统中的压力的增加用于测量氧的增加。设置压力传感器获得 s,每 2 点的数据,然后运行 120 美国泡沫试验应该是可见的如过氧化物分解为氧气和水。
当反应期结束,释放压力和处置的过氧化氢溶液。冲洗管,然后将管装满下的过氧化氢溶液。所有解决方案重复气体压力测量。
情节的压力随时间的数据,为每个解决方案。进化的氧气的压力与氧形成根据理想气体定律的痣成正比。以下化学反应,形成的氧的痣可以用于计算分解过氧化氢的痣。首先,假设,过氧化氢浓度没有明显改变实验短期间。因此,绘制的数据表示只有初始区域动力学实验。
确定每个数据集使用线性回归的斜率。斜率等于压氧每秒为单位的初始反应速率。
接下来,自然对数的初始反应速率 vs 绘制初始过氧化氢浓度的自然对数。斜率等于反应级数,m,和约等于一。因此,反应为一级反应。
为每个审判速度压力在托尔,每秒为单位。若要确定的速率常数,先转换率单位每秒的大气。因为泡沫演变在水溶液中,减去蒸气压力的水从每个审判的系统压力。然后新利率只反映了由于氧压力。
应用理想气体定律,转换率从大气本身摩尔每 s 为每个审判。两次生产黑痣是氧气的等于过氧化氢分解,根据化学反应化学计量比的痣。然后,使用反应体积转换率的单位为每秒的摩尔浓度。
确定每个审判的速率常数除以率在 s 每摩尔的初始浓度。在这个实验中,平均速率常数、 k,是大约 1.48 x 10-4每 s。反应是一阶,已知从自然对数-自然对数图前面显示。因此,可以写入速率定律,如图所示。
现在,你看过如何确定为一种化学反应速率定律,让我们看看一些适用这一概念的领域。
化学反应被用于合成化合物及材料在广泛的科学应用中使用。它是反应的重要的是反应的理解这些合成步骤,反应速率控制的研究进展。
例如,镉硒化物纳米晶和纳米棒的合成收益通过一系列的化学反应。每个反应有自己离散反应速率,并且因此合成一步仔细控制基于知识速度的反应;有些慢,有些非常迅速。
反应速率定律也可以用来描述放射性衰变,并确定半衰期的放射性物质。半衰期是指一种物质的浓度下降到其初始浓度的一半所需的时间量。
放射性遵循一级动力学,意思,放射性物质衰变到安全所需的时间水平可以被很好的特点,使适当的运输和储存的放射性材料和放射性废物。
类似于放射性材料,药物也有一个半衰期和在体内的降解。例如,一些药物有高的速率常数,他们必须经常被并很快,降解。这种降解率的知识使适当的剂量、 用法和交付方法测定。
你刚看了反应速率的朱庇特的简介。现在,您应该了解化学反应的不同订单、 他们如何与相关化学反应速率,以及如何确定为实验室中给定的化学反应速率定律。
谢谢观赏 !
Subscription Required. Please recommend JoVE to your librarian.
Results
氧气演变数据和初始速率

图 1。压力与时间数据为每个审判在恒定的温度。斜率等于反应瞬时速率。
反应级数
- 五审判和图的边坡数据被表格下方 (表 2,图 2)。0.9353 ≈ 1,边坡是一个整数值,其反应级数。

表 2。5 H2O2试验的结果。

图 2。自然对数图的浓度-率。边坡是等效的顺序的反应。
速率常数k
- 在第一次减去了 294 k (动力学实验温度),水的蒸气压 18.7 乇使用理想气体定律的 mol O2/s 率的计算。
- 除以率、 [H2O2] /s [H2O2]0的初始浓度计算速率常数。

表 3。计算的速率常数, k。
- 平均速率常数,2.25 x 10-4的-1指示的反应是基于单位的第一秩序。速率定律可以重写为: 率 = 2.25 x 10-4的-1[H2O2]0
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
而数学上可以参与确定率法变量,方法是实际上非常简单。只要可以量测的反应物消失或产品外观,率情节可以用来计算速率常数。该方法的扩展常用来确定反应活化能的,电子,通过率测量和计算在各种温度下的速率常数。这种方法涉及使用阿伦尼乌斯方程, k = Ae(-Ea/RT)。结合率法,包括反应级数、 活化能量的反应提供如何快 (或慢) 反应完全动力学配置文件进步并且提供真实世界的信息因素如何喜欢温度和浓度可以影响这种反应。
化学动力学在行业和各个领域,包括药品、 核安全、 环境治理、 和防晒霜中得到应用。例如,某些药物可能有非常大的速率常数,意味着它在体内衰减很快。这会影响使用、 加药,和交付方法。关于核科学,放射性遵循一阶动力学,意味着核材料衰变到一个安全的水平所需的时间很好的特点。测量将非常类似于在这里提出的方法,也可以适用于许多环境污染物的朽烂。同样,防晒霜也腐烂与已知动力学配置文件允许厂家告知消费者如何很快防晒霜需要应用必须保持安全水平。
Subscription Required. Please recommend JoVE to your librarian.
References
- Method adapted from Vetter, T. A., Colombo, D. P. Jr. Kinetics of Platinum-Catalyzed Decomposition of Hydrogen Peroxide, J. Chem. Ed. 80 (7), 788-798 (2003).
- David R. Lide, ed. CRC Handbook of Chemistry and Physics. Boca Raton, Florida: CRC Press (2005).





 。以自然对数 (ln) 的方程产生一个线性方程
。以自然对数 (ln) 的方程产生一个线性方程 , m,边坡,哪里的反应顺序。
, m,边坡,哪里的反应顺序。