Overview
Quelle: Labor von Dr. Neal Abrams – SUNY College of Environmental Science and Forestry
Alle chemische Reaktionen haben eine spezifische Definition des Fortschritts der Edukte zu Produkten. Diese Rate kann durch Temperatur, Konzentration und die physikalischen Eigenschaften der Edukte beeinflusst werden. Der Preis beinhaltet auch die Zwischenprodukte und Transformationsstaaten, die gebildet werden, aber sind weder die Edukt noch das Produkt. Das Tarif-Gesetz definiert die Rolle der einzelnen Reaktionspartner in einer Reaktion und kann verwendet werden, um den Zeitaufwand für eine Reaktion auf gehen mathematisch zu modellieren. Die allgemeine Form einer Rate Gleichung wird unten gezeigt:
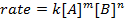
wo A und B Konzentrationen von verschiedenen Molekülsorten, m und n sind sind Reaktion Aufträge, und k ist die Geschwindigkeitskonstante. Die Geschwindigkeit der nahezu jede Reaktion ändert im Laufe der Zeit als Reaktionspartner erschöpft sind, so dass wirksame Kollisionen weniger wahrscheinlich auftreten. Die Rate konstant, ist jedoch für jede einzelne Reaktion bei einer gegebenen Temperatur fixiert. Die Reaktionsordnung zeigt die Anzahl der in einer Reaktion beteiligten molekularen Spezies. Es ist sehr wichtig zu wissen, das Rate Gesetz, einschließlich Rate konstante und Reaktion Anordnung, die nur experimentell ermittelt werden können. In diesem Experiment werden wir eine Methode zur Bestimmung der Geschwindigkeit rechts erkunden und verwenden, um den Fortschritt einer chemischen Reaktion zu verstehen.
Principles
Kinetik und Thermodynamik
Alle chemische Reaktionen richten sich nach zwei Faktoren, Kinetik und Thermodynamik. Der thermodynamische Faktor ist der Unterschied in der freien Energie während einer chemischen Reaktion freigesetzt. Diese kostenlose Energie, Spontaneität, genannt ist ein komplexer Wert durch die Enthalpie (Wärme) und Entropie (Störung) innerhalb einer chemischen Reaktion entstehen. Kinetik bezieht sich auf die Geschwindigkeit einer chemischen Reaktion und wie schnell das System Gleichgewicht erreicht. Während Kinetik die Geschwindigkeit der Reaktion erklären kann, liefert Thermodynamik Informationen über die Energetik. Einfach gesagt, Thermodynamik bezieht sich auf die Stabilität und Kinetik bezieht sich auf Reaktivität.
Bestimmung
Rate ist eine zeitabhängige Messung, was bedeutet, dass es ständig verändert, da eine Reaktion verläuft. Dies kann mit einem Differential Rate Gesetz, mit dem Ausdruck der Veränderung der Konzentration über eine Änderung in der Zeit dargestellt werden. Experimentell ist das Differential Rate recht schwierig zu bedienen, so können wir Kalkül verwenden und das Tarif-Gesetz als das integrierte Rate Gesetz repräsentieren durch die Integration der Differential-Rate Gesetz. Das integrierte Rate Gesetz stellt die Reaktion-Konzentrationen zu Beginn der Reaktion und in einem angegebenen Zeitintervall. Eine Tabelle der Ordnung, Rate Gesetz und integrierten Rate Gesetz ist nachfolgend dargestellt:

Jede Bestellung erklärt die Abhängigkeit der Reaktanten Konzentration auf die Reaktionsgeschwindigkeit. Zum Beispiel eine nullter Ordnung Rate Gesetz, Rate = k, deutet darauf hin, dass die Rate nur auf die Rate konstant, nicht auf Edukt Konzentration abhängt. Dies ist häufig bei katalytischen Reaktionen, wo der Katalysator ist eine solide und die Fläche bleibt unverändert während der Reaktion. Eine 1St Rate Gesetz zeigt, dass die Rate abhängig von der Konzentration eines Reaktanten, obwohl andere Reaktionspartner vorhanden sein können. Ein 2Nd Rate Gesetz zeigt, dass die Rate abhängig von der Konzentration der beiden Reaktanden in der Reaktion ist. Diese Edukte können gleich sein, d.h. Rate = k[A]2, oder anderen, Geschwindigkeit = k[A] [B]. Da die zwei Konzentrationen ständig ändern, können zweite Bestellung Geschwindigkeitskonstanten schwierig, im Labor zu messen sein. Unabhängig von der Reihenfolge, mit dem integrierten Rate Gesetz vereinfacht die Datenanalyse durch ermöglicht Daten Plotten und Anwendung einer linearen Gleichung um die Daten zu passen. Da nur eine integrierte Rate Gesetz die Daten passen, kann eine Reaktion Rate konstante und Reaktion Bestellung sofort identifiziert werden.
Eine Kinetik-Experiment
Bestimmung der Geschwindigkeit rechts beginnt mit der Einrichtung einer Kinetik-Experiments für die chemische Reaktion. Eine Kinetik-Experiment wird sorgfältig kontrolliert, so dass Messungen in regelmäßigen Abständen durchgeführt werden, um die Veränderung der Konzentration einer Spezies im Laufe der Zeit zu bestimmen. Arten können entweder sein Reaktionspartner (abnehmender Konzentration mit der Zeit) oder ein Produkt (zunehmende Konzentration mit der Zeit). Wenn mehrere Reaktionspartner beteiligt sind, ist es auch sehr wichtig, dass die Konzentration des einzigen Reaktanten mit der Zeit ändert. Erhöhung der Konzentration der Reaktanden viel höher als das Edukt untersucht, macht es den Anschein, dass die Konzentration des einzigen Reaktanten während des Experiments ändert.
In diesem Experiment wird die katalytische Zersetzung von Wasserstoffperoxid über einem Platinkatalysator untersucht. Da das Platin als Katalysator ist, ist nur eine Art beteiligt, die in zwei Produkte entsprechend der folgenden Reaktion zerfällt:
2 H2O2(Aq) → O2(g) + 2 H2O(l)
Da eines der Produkte, O2, ein Gas ist, kann die Zunahme des Drucks des Systems im Laufe der Zeit gemessen werden und das ideale Gasgesetz (PV = nRT) verwendet, um Druck auf Maulwürfe zu beziehen. Danach für mehrere verschiedene Konzentrationen der Reaktionspartner ist, kann die Reaktion Reihenfolge und Rate Gesetz gelöst werden.
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. Vorbereitung H2O2 Verdünnungen
- Lager 3 % Wasserstoffperoxid hat eine Konzentration von 0,882 M. bereiten 5 Verdünnungen von 0,882 M bis hin zu 0,176 M (Tabelle 1). Diese Lösungen volumetrisch vorbereiten, aber sie Additiv vorzubereiten, da der gelöste Stoff sehr verdünnte ist und Wassermengen sind additiv.
- Legen Sie die Lösungen in einem Wasserbad konstante Temperatur oder lassen Sie sie auf die Bank oben nach equilibrate bei Raumtemperatur. Ein Temperaturbereich von 20 – 25 ° C (293-298 K) ist gut für diese Reaktion.

Tabelle 1. H2O2 Lösungen verwendet.
2. Vorbereitung den Reaktionsbehälter
- Bestimmen die Lautstärke von den Reaktionsbehälter, ein großes Reagenzglas nach oben zu füllen, mit Wasser und legen eine 1-Loch Gummistopfen in das Reagenzglas bis zum Anschlag und das Wasser drückt die Seiten und nach oben.
- Entfernen Sie den Stopfen und gießen Sie das Wasser in einen Messzylinder, die genaue Menge des Wassers zu bestimmen. Dies ist das Gesamtvolumen des Reaktionsgefäßes (Reagenzglas).
3. Messung der Sauerstoffentwicklung
- Ersetzen Sie das Wasser mit 50 mL die erste Wasserstoff-Peroxid-Lösung und setzen Sie es wieder in das Wasserbad. Sobald equilibriert, fügen Sie Platin beschichtet Reaktion Disk hinzu und versiegeln Sie das System mit einem Stopfen mit einem Gas-Druck-Sensor verbunden. Diese Scheiben sind in Kontaktlinse Reinigungssysteme verbreitet.
- Sobald der Drucksensor Setup, um Daten auf 2 Punkte/s zu erwerben ist, führen Sie das Experiment für 120 s. Die Vernier Gas-Druck-Sensor, GPS-BTA, empfiehlt sich für dieses Experiment.
- Bläschen sollten beachtet werden, da das Wasserstoffperoxid zu Sauerstoff und Wasser zersetzt ist. Lassen Sie den Druck, entsorgen Sie die Lösung, spülen, und ersetzen Sie die Lösung mit der nächsten Wasserstoffperoxid-Lösung zu. Wiederholen Sie Gas Druckmessung, bis alle Lösungen getestet werden.
(4) Datenanalyse
- Übertragen Sie alle Datendateien des Drucks im Vergleich zur Zeit an ein Tabellenkalkulationsprogramm.
- Bestimmung der anfänglichen raten-davon ausgehen, dass die Konzentration von Wasserstoffperoxid nicht viel in dem kurzen Zeitraum des Experiments geändert hat. Die Daten stellen ersten linearen Bereichs des Experiments Kinetik.
- Hang durch Plotten Druck gegenüber der Zeit und mit einem Hang zu bestimmen Formel oder lineare Regression. Darstellen Sie den Druck in eine gemeinsame Einheit.
- Die Steigung ist die erste Rate in Einheiten des DrucksO2/s.
- Bestimmung der Reaktionsordnung
- Weil Druck entwickelte O2 direkt proportional zu der Muttermale zerlegten H2O2 ist, ergibt Plotten der ln (Anfangsrate) vs. ln [H2O2]0 Abhanges Reihenfolge der Reaktion entspricht. Die anfängliche Konzentration von Wasserstoffperoxid, [H2O2]0, ist was in den einzelnen Studien verwendet wurde.
- Die Gleichung für die Tarif-Gesetz ist
 . Einnahme von natürlichen Logarithmus (ln) die Gleichung eine linearen Gleichung produziert
. Einnahme von natürlichen Logarithmus (ln) die Gleichung eine linearen Gleichung produziert  , wo m, die Steigung ist die Reihenfolge der Reaktion.
, wo m, die Steigung ist die Reihenfolge der Reaktion.
- Die Gleichung für die Tarif-Gesetz ist
- Weil Druck entwickelte O2 direkt proportional zu der Muttermale zerlegten H2O2 ist, ergibt Plotten der ln (Anfangsrate) vs. ln [H2O2]0 Abhanges Reihenfolge der Reaktion entspricht. Die anfängliche Konzentration von Wasserstoffperoxid, [H2O2]0, ist was in den einzelnen Studien verwendet wurde.
- Bestimmung der Rate Konstante, k
- Für jeden Versuch wandeln Sie die Rate, PO2/s, in Einheiten von atm/s wenn die Rate in einer anderen Einheit wie mm Hg/s ist.
- Da Luftblasen in wässriger Lösung entwickelt wurden, Subtrahieren der Dampfdruck des Wassers aus der Systemdruck für jeden Versuch. Der neue Satz spiegelt nur den Druck aufgrund der Sauerstoffentwicklung.
- Wenden Sie das ideale Gasgesetz um die Rate von atm/s in Mol/s in jede Testversion konvertieren.
- Ordnen Sie PV = nRT, n = PV/RT. Die s-1 Einheit bleibt unverändert. Das Volumen entspricht das Reagenzglas Volumen minus das Volumen der Lösung (50 mL).
- Verwenden Sie die ausgewogene chemische Reaktion konvertieren von Mol Sauerstoff produziert, um Maulwürfe von Wasserstoffperoxid in jeder Prüfung zerlegt.
- Teilen Sie die Maulwürfe von H2O2 durch das Volumen der Lösung, 0,050 L Molarity von H2O2 pro Sekunde, [H2O2] zerlegt Ausbeute / s.
- Da dieses Experiment Kinetik erster Ordnung folgt, teilen Sie die Rate, [H2O2] / s durch die ursprüngliche Lösungskonzentration für jede Studie, [H2O2]0, um eine Rate Konstante, kzu erzielen. Diese Lösung für die Geschwindigkeitskonstante würde variieren etwas in der Größenordnung von der Reaktion vorher bestimmt.
- Durchschnitt der Geschwindigkeitskonstanten für jeden Versuch zusammen, da die Temperatur konstant ist.
Alle chemische Reaktionen haben eine spezifische Rate, die festlegt, wie schnell der Reaktanden in Produkte umzusetzen.
Chemische Reaktionen sind durch zwei Faktoren bestimmt: Kinetik und Thermodynamik. Thermodynamische Faktoren entfallen, unabhängig davon, ob eine Reaktion erfolgt, und wenn es aufnimmt oder abgibt Energie während des Prozesses.
Kinetik bezieht sich auf die Geschwindigkeit einer chemischen Reaktion, und wie schnell das System Gleichgewicht erreicht. Die Kinetik der Reaktion beschreibt die kinetischen Rate Gesetz bestimmt den Preis basiert auf einer Reaktionsratenkonstante, die Konzentration der Komponenten und die Reihenfolge der Reaktion.
Dieses Video führt mit der Rate Gesetz Gleichung Reaktionskinetik und demonstriert, wie bestimmt sich der Preis Recht für eine bestimmte Reaktion im Labor.
Für eine allgemeine Reaktion die Reaktionsgeschwindigkeit entspricht die Geschwindigkeitskonstante Zeiten die Konzentrationen der Edukte, jeweils auf eine Reaktionsordnung angehoben. Die Rate Konstante, k, für eine Reaktion bei einer gegebenen Temperatur festgelegt ist.
Die Reaktion Aufträge sind unabhängig von der stöchiometrischen Koeffizienten. Stattdessen sind abhängig von den Reaktionsmechanismus, und veranschaulichen, wie die Rate, mit der Konzentration der Reaktanden zusammenhängt. Beispielsweise wenn die Geschwindigkeit der Reaktion unverändert ist wenn die Konzentration von "A" verdoppelt, dann die Reaktion hängt nicht von Konzentration und die Reihenfolge ist null.
Wenn die Rate verdoppelt sich, wenn die Konzentration der Reaktionspartner "A" verdoppelt, ist die Reaktion erster Ordnung in Bezug auf "A"("." Das gleiche Verhalten gilt für Reaktionspartner "B". Der Gesamtauftrag einer Reaktion ist die Summe der individuellen Reaktion Aufträge für jedes Edukt.
Während einer Reaktion ändert sich die Konzentration der Reaktanden mit der Zeit. Beachten Sie, dass die grundlegende Gleichung Rate nicht die Zeit als Variable beinhaltet, und kann nur Geschwindigkeit und Konzentration zu einem bestimmten Zeitpunkt beziehen. Die Rate ändert sich jedoch im weiteren Verlauf die Reaktion und als Edukte verbraucht sind. Mit einem Differential Rate Gesetz kann die Änderung in der Konzentration auf Zeit beziehen.
Das Tarif-Gesetz für eine Reaktion muss experimentell bestimmt werden wo eine chemische Reaktion bei konstanter sorgfältig gesteuert wird gemessen Temperatur und der Konzentration der Reaktanden oder Produkte in bestimmten Zeitabständen. Da Konzentrationsmessungen zu diskreten Zeitpunkten vorgenommen werden, ist das Differential Rate recht schwierig zu experimentellen Daten korrelieren.
Integration der Differential-Rate Gesetz resultiert eine einfachere Gleichung, die integrierte Rate Gesetz genannt. Das integrierte Rate Gesetz vergleicht die Konzentrationen der Reaktanten zu Beginn der Reaktion und zu einem bestimmten Zeitpunkt.
Die integrierte Rate Gesetz Gleichung variiert abhängig von der Reihenfolge der Reaktion. Diese Gleichungen können die lineare Form y = Mx + b. So ein Grundstück von Konzentration Vs Zeit ergibt einer linearen Handlung für eine Null Auftrag Gleichung, ein Grundstück von den natürlichen Logarithmus der Konzentration Vs Zeit ergibt einer linearen Handlung für eine erste Bestellung Gleichung, und So weiter. Durch den Einbau von experimenteller Daten zu diesen Gleichungen, kann die Reihenfolge der Reaktion leicht ermittelt werden. Die Rate Konstante, k, dann ermittelt werden mit der Steigung der geraden. Zu guter Letzt variieren die Einheiten der k abhängig von der Reihenfolge der Reaktion. Für eine Reaktion Null Ordnung der Einheiten sind Maulwürfe pro Liter pro Sekunde, für eine erste Reaktion der Ordnung, die Einheiten sind inverse Sekunden und für eine zweite Bestellung-Reaktion sind die Einheiten Liter pro Mol pro Sekunde.
Jetzt, da die Grundlagen der kinetischen Rate Gesetze erläutert haben, werfen wir einen Blick an, wie man experimentell bestimmen die Rate Gesetz für die Zersetzung von Wasserstoffperoxid zu Wasser und Sauerstoff.
In diesem Experiment wird die katalytische Zersetzung von Wasserstoffperoxid über einem Platinkatalysator untersucht.
Zuerst bereiten Sie 5 Verdünnungen von Wasserstoffperoxid, wie in der Tabelle dargestellt. In diesem Fall verwendet Konzentrationen reichen von 0.882 – 0,176 M, ein 3 % oder 0,882 M-Stammlösung. Lassen Sie die Lösung auf Raumtemperatur equilibrate.
Als nächstes bereiten Sie den Reaktionsbehälter mit einem Reagenzglas. Zuerst bestimmen Sie die Lautstärke von einem großen Reagenzglas nach oben mit Wasser zu füllen. Fügen Sie dann 1-Loch Gummistopfen, bis es eng ist und Wasser aus dem Loch nach oben schiebt.
Entfernen Sie den Stopfen, und gießen Sie das Wasser in einen Messzylinder, das genaue Volumen zu messen. Dies ist das Volumen von den Reaktionsbehälter.
Dann gießen Sie 50 mL die erste Wasserstoff-Peroxid-Lösung in das Reagenzglas und legen Sie dann den Schlauch in die 25 ° C-Wasserbad. Sobald equilibriert, fügen Sie eine Platin beschichtete Reaktion Disk hinzu und versiegeln Sie das System mit einem Stopfen mit einem Gas-Druck-Sensor verbunden.
Da eines der Produkte Sauerstoffgas ist, wird der Anstieg des Drucks im System verwendet, um die Erhöhung der Sauerstoff messen. Einrichten des Drucksensors, Daten an 2 Punkten pro s zu erwerben, dann führen Sie das Experiment für 120 S. Bläschen sichtbar sein soll, wie das Wasserstoffperoxid zu Sauerstoff und Wasser zersetzt.
Wenn die Reaktionszeit vorbei ist, den Druck ablassen und entsorgen der Peroxid-Lösung. Spülen Sie das Rohr, dann füllen Sie das Rohr mit der nächsten Wasserstoffperoxid-Lösung. Wiederholen Sie die Gas-Druck-Messung für alle Lösungen.
Darstellen Sie den Druck im Vergleich zu Zeitdaten für jede Lösung. Der Druck der weiterentwickelten Sauerstoff ist direkt proportional zu den Molen Sauerstoff gebildet nach dem idealen Gas-Gesetz. Im Anschluss an die chemische Reaktion können die Maulwürfe von Sauerstoff gebildet verwendet werden, um die Maulwürfe zersetzt Wasserstoffperoxid zu berechnen. Zunächst davon ausgehen Sie, dass die Konzentration von Wasserstoffperoxid während der kurzen Dauer des Experiments nicht wesentlich ändern. Daher stellt die gezeichneten Daten nur die erste Region des Experiments Kinetik.
Bestimmen Sie die Steigung der jeden Datensatz mit einer linearen Regression. Die Steigung ist gleich der anfänglichen Reaktionsgeschwindigkeit in Einheiten des Drucks der Sauerstoff pro Sekunde.
Als nächstes Grundstück von dem natürlichen Logarithmus der erste Reaktion Rate Vs natürlichen Logarithmus von Peroxid Ausgangskonzentration. Die Steigung ist gleich die Reaktionsordnung m, und ist ungefähr gleich eins. Daher ist die Reaktion erster Ordnung.
Die Rate für jeden Versuch ist in Einheiten von Druck in Torr, pro Sekunde. Um festzustellen, die Rate konstant, zuerst konvertieren Sie die Rate auf Einheiten von Atmosphären pro Sekunde. Weil die Luftblasen in der wässrigen Lösung entwickelt, Subtrahieren der Dampfdruck des Wassers aus der Systemdruck für jeden Versuch. Der neue Tarif reflektiert dann nur den Druck aufgrund der Sauerstoffentwicklung.
Wenden Sie das ideale Gasgesetz um die Rate von Atmosphären schlechthin in Mol pro s für jeden Versuch zu konvertieren. Zwei Mal die Maulwürfe von Sauerstoff produziert entsprechen die Maulwürfe von Wasserstoffperoxid zerlegt, nach der chemischen Reaktion Stöchiometrie. Verwenden Sie dann das Reaktionsvolumen Molarity pro Sekunde die Einheiten der Rate konvertieren.
Bestimmen Sie die Geschwindigkeitskonstanten für jeden Versuch durch Division die Rate im Molarity pro s durch die Ausgangskonzentration. In diesem Experiment, die durchschnittliche Rate konstant, k etwa 1,48 x 10-4 pro s ist. Die Reaktion ist erster Ordnung, bekannt aus den natürlichen Logarithmus - natürlicher Logarithmus Plot zuvor gezeigten. Daher kann die Rate Gesetz geschrieben werden, wie gezeigt.
Nun, da Sie wie bestimmt sich der Preis Recht für eine chemische Reaktion angeschaut haben, sehen wir uns an einigen Stellen wo dieses Konzept angewendet wird.
Chemische Reaktionen sind in der Synthese von Verbindungen und Materialien, die verwendet in einer Vielzahl von wissenschaftlichen Anwendungen verwendet. Es ist wichtig zu verstehen, die Reaktionsgeschwindigkeit in dieser Synthese Schritte, um den Fortschritt der Reaktion zu kontrollieren.
Zum Beispiel durchläuft die Synthese von Kadmium metallisches Nanokristallen und Laptops eine Reihe von chemischen Reaktionen. Jede Reaktion hat eine eigene diskrete Reaktionsgeschwindigkeit und daher Synthese Schritt wird sorgfältig kontrolliert, basierend auf Wissen-Geschwindigkeit der Reaktion; einige langsam und einige sehr schnell.
Die Reaktion Rate Gesetz kann auch verwendet werden, um radioaktiven Zerfall zu beschreiben und die Halbwertszeit von radioaktivem Material zu bestimmen. Half-Life bezieht sich auf die benötigte Zeit für die Konzentration eines Materials, die Hälfte der ursprünglichen Konzentration fallen.
Radioaktivität folgt erster Ordnung Kinetik, was bedeutet, dass der Zeitaufwand für radioaktives Material zu einem sicheren Verfall Ebene sehr gut charakterisiert werden kann, so dass sachgemäßen Transport und Lagerung von radioaktivem Material und radioaktiver Abfälle.
Ähnlich wie bei radioaktiven Stoffen, Drogen haben eine Halbwertszeit auch im Körper abgebaut. Zum Beispiel haben einige Medikamente hohe Rate konstanten, was bedeutet, dass sie schnell abgebaut, und häufig getroffen werden. Kenntnisse über diese Abbaurate ermöglicht die Bestimmung der geeigneten Dosierung, Anwendung und Anlieferung Methode.
Sie habe nur Jupiters Einführung in die Reaktionsgeschwindigkeiten beobachtet. Sie sollten jetzt verstehen die unterschiedlichen Aufträge von chemischen Reaktionen, wie sie chemische Reaktionsgeschwindigkeiten beziehen und wie bestimmt sich der Preis Recht für eine bestimmte chemische Reaktion im Labor.
Danke fürs Zuschauen!
Subscription Required. Please recommend JoVE to your librarian.
Results
Sauerstoff-Evolution-Data und erste Preise

Abbildung 1: Druck vs. Zeitdaten für jeden Versuch bei konstanter Temperatur. Die Steigung entspricht der momentanen Rate der Reaktion.
Reaktionsordnung
- Daten für fünf Versuche und Grafik mit Steigung ist tabellarisch (Tabelle 2 und Abbildung 2). Die Steigung der 0.9353 ≈ 1, ist ein ganzzahliger Wert von der Reaktionsordnung.

Tabelle 2. Ergebnisse 5 H2O2 Versuche.

Abbildung 2: Natürlicher Logarithmus Grundstück Konzentration vs. Rate. Die Neigung entspricht Reihenfolge der Reaktion.
Geschwindigkeitskonstante k
- Berechnen Sie die Rate in Mol O2/s mit dem idealen Gas-Gesetz durch erste Subtraktion aus dem Dampfdruck des Wassers bei 294 K (Temperatur des Experiments Kinetik), 18,7 mm Hg.
- Berechnen Sie die Rate konstant durch Division der Rate, [H2O2] / s durch die Ausgangskonzentration [H2O2]0.

Tabelle 3. Berechnung der Rate konstant, k.
- Die durchschnittliche Rate konstant bedeutet 2,25 x 10-4 s-1 die Reaktion erster Ordnung anhand der Einheiten. Das Tarif-Gesetz könnte als umgeschrieben werden: Preis = 2,25 x 10-4 s-1[H2O2]0
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Während Bestimmung Rate Gesetz Variablen mathematisch beteiligt sein kann, sind die Methoden eigentlich ganz einfach. Solange das Verschwinden der Reaktionspartner oder Erscheinungsform eines Erzeugnisses gemessen werden kann, können Rate Grundstücke verwendet, um die Rate konstant zu berechnen. Eine Erweiterung dieser Methode wird häufig verwendet, um die Aktivierungsenergie einer Reaktion, Eein, bestimmen die Messrate und die Berechnung der Rate konstant bei verschiedenen Temperaturen. Bei dieser Methode wird unter Verwendung der Arrhenius-Gleichung, k = Ae(-Ea/RT). Rate Gesetzes, einschließlich Reaktionsordnung kombiniert, mit der Aktivierung Energie einer Reaktion liefert eine vollständige kinetische Profil wie schnell (oder langsam) eine Reaktion fortschreitet und bietet praxisnahe Informationen über Faktoren wie Temperatur und Konzentration, Reaktion beeinflussen kann.
Chemische Kinetik finden Anwendungen in Branchen und Bereichen wie Pharma, nukleare Sicherheit, Umweltsanierung und Sonnenschutzmittel. Beispielsweise kann ein bestimmtes Medikament haben eine sehr große Rate konstant, was bedeutet, dass es sehr schnell im Körper zerfällt. Dies betrifft Verwendung, Dosierung und Anlieferung Methode. In Bezug auf nukleare Wissenschaft folgt Radioaktivität Kinetik erster Ordnung, was bedeutet, dass der Zeitaufwand für Kernmaterial, auf ein sicheres Niveau zu verfallen sehr gut charakterisiert ist. Messungen wäre sehr ähnlich wie die hier vorgestellte Methode und auch zum Verfall der viele Umweltschadstoffe angewandt werden könnte. In ähnlicher Weise zerfallen Sonnenschutzmittel auch mit bekannten kinetischen Profile ermöglicht Herstellern zur Information der Verbraucher wie schnell die Sonnencreme muss angewendet werden, um sichere Niveau zu halten.
Subscription Required. Please recommend JoVE to your librarian.
References
- Method adapted from Vetter, T. A., Colombo, D. P. Jr. Kinetics of Platinum-Catalyzed Decomposition of Hydrogen Peroxide, J. Chem. Ed. 80 (7), 788-798 (2003).
- David R. Lide, ed. CRC Handbook of Chemistry and Physics. Boca Raton, Florida: CRC Press (2005).





 . Einnahme von natürlichen Logarithmus (ln) die Gleichung eine linearen Gleichung produziert
. Einnahme von natürlichen Logarithmus (ln) die Gleichung eine linearen Gleichung produziert  , wo m, die Steigung ist die Reihenfolge der Reaktion.
, wo m, die Steigung ist die Reihenfolge der Reaktion.