Overview
Fuente: Laboratorio de Dr. Neal Abrams — Universidad de SUNY de la ciencia ambiental y silvicultura
Todas las reacciones químicas tienen una tasa específica de definir el progreso de reactantes a productos. Esta tasa puede ser influenciada por la temperatura, concentración y las propiedades físicas de los reactivos. La tarifa incluye también los productos intermedios y Estados de transición que se forman son el reactivo ni producto. La ley tasa define el papel de cada reactivo en una reacción y puede utilizarse para modelar matemáticamente el tiempo necesario para que una reacción proceder. A continuación se muestra la forma general de una ecuación del tipo:
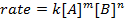
donde A y B son las concentraciones de diferentes especies moleculares, m y n son órdenes de reacción, y k es la constante de velocidad. La velocidad de cada reacción cambia con el tiempo como se agotan los reactivos, hacer colisiones eficaces menos probables que ocurra. La constante de velocidad, sin embargo, es fijo para cualquier sola reacción a una temperatura determinada. El orden de reacción ilustra el número de especies moleculares involucradas en una reacción. Es muy importante conocer la ley de la tarifa, incluyendo orden de tasa constante y reacción, lo que sólo puede ser determinado experimentalmente. En este experimento, exploraremos un método para la determinación de la ley de tasa y utilizarlo para comprender el progreso de una reacción química.
Principles
Cinética y termodinámica
Todas las reacciones químicas se rigen por dos factores, la cinética y la termodinámica. El factor termodinámico es la diferencia en la energía libre liberada durante una reacción química. Esta energía libre, como espontaneidad, es un valor complejo de la entalpia (calor) y entropía (desorden) dentro de una reacción química. Cinética se refiere a la velocidad de una reacción química y cómo rápidamente el sistema alcanza el equilibrio. Mientras que la cinética puede explicar la velocidad de la reacción, la termodinámica aporta información sobre su energía. En pocas palabras, la termodinámica se refiere a la estabilidad y cinética se relaciona con la reactividad.
Determinar la tasa de
Tasa es una medida basada en tiempo, lo que significa que está en constante cambio como producto de una reacción. Esto puede ser representado mediante una ley diferencial de velocidad, expresando el cambio en la concentración por un cambio en el tiempo. Experimentalmente, la ley diferencial de velocidad es difícil de usar, así que podemos utilizar cálculo y representar la ley de la tasa como la ley de tarifa integrada integrando la ley diferencial de velocidad. La ley de tarifa integrada representa las concentraciones de la reacción en el inicio de la reacción y en un intervalo de tiempo especificado. A continuación se muestra una tabla de la orden, tasa y tarifa integrada:

Cada orden, explica la dependencia de la concentración de reactivo en la velocidad de reacción. Por ejemplo, una ley de velocidad de orden cero, velocidad = k, indica que la tasa sólo es dependiente en la constante de velocidad, no en la concentración de reactivo. Esto es común en reacciones catalíticas donde el catalizador es un sólido y la superficie no cambia durante la reacción. Una ley de velocidad de ordenst 1 muestra que la tasa es dependiente en la concentración de un reactivo, aunque otros reactivos pueden estar presentes. Una ley de velocidad de orden 2nd indica que la tasa es dependiente en la concentración de dos reactivos en la reacción. Los reactivos pueden ser la misma, es decir, tasa = k[A]2, o tarifa diferente, = k[A] [B]. Puesto que las dos concentraciones están en constante cambio, constantes de velocidad de segundo orden pueden ser difíciles de medir en el laboratorio. Independientemente de la orden, usando la ley de tarifa integrada simplifica el análisis de datos permitiendo para los datos trazado y la aplicación de una ecuación lineal para ajustar los datos. Puesto que la ley sólo una tarifa integrada a ajustar los datos, orden de reacción y constante de tasa de una reacción puede identificarse inmediatamente.
Un experimento de cinética de
Determinación de la ley de tasa comienza con la creación de un experimento de cinética para la reacción química. Un experimento de cinética es controlado cuidadosamente para que las mediciones se hacen en intervalos de tiempo para determinar el cambio en la concentración de una especie en el tiempo. Que especie puede ser un reactivo (disminuyendo la concentración con el tiempo) o un producto (aumento de concentración con el tiempo). Si participan varios reactantes, también es muy importante que la concentración de solo reactivo cambia con el tiempo. Aumento de la concentración de los reactivos mucho más altos que el reactivo está estudiando hace parecer que la concentración de solo reactivo cambia durante el experimento.
En este experimento, se explora la descomposición catalítica del peróxido de hidrógeno sobre un catalizador de platino. Dado que el platino es un catalizador, sólo una especie está implicada que se descompone en dos productos según la reacción siguiente:
2 H2O2(aq) → O2(g) + 2 H2O(l)
Porque uno de los productos, O2, es un gas, el aumento en la presión del sistema con el tiempo puede ser medido y la ley del Gas Ideal (PV = nRT) utilizada para relacionar presión con lunares. Una vez que se realiza para varios diferentes concentraciones de lo reactivo, la ley de orden y velocidad de reacción puede ser resuelto.
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. preparación de H2O2 diluciones
- Stock 3% peróxido de hidrógeno tiene una concentración de las diluciones de preparar 5 0,882 M. desde M 0,882 0,176 m (tabla 1). Preparar estas soluciones volumétricamente, pero prepararlos aditiva ya que el soluto es muy diluido y volúmenes de agua son aditivos.
- Colocar las soluciones en un baño de temperatura constante o dejarlas en la mesa se equilibren a temperatura ambiente. Una gama de temperaturas de 20 – 25 ° C (293 – 298 K) es buena para esta reacción.

Tabla 1. H2O2 soluciones que se utilizan.
2. preparar el recipiente de la reacción
- Para determinar el volumen de la vasija de reacción, llene un tubo de ensayo grande en la parte superior con agua e Inserte un tapón de goma 1 orificio en el tubo de ensayo hasta que este apretado y el agua empuja los lados y a través de la parte superior.
- Quite el tapón y vierta el agua en una probeta graduada para determinar el volumen exacto de agua. Este es el volumen total del recipiente de reacción (probeta).
3. medir la evolución de oxígeno
- Reemplace el agua con 50 mL de la primera solución de peróxido de hidrógeno y coloque en el baño de agua. Una vez equilibrado, agregar el disco recubierto de platino de la reacción y el sistema del sello con un tapón conectado a un sensor de presión de gas. Estos discos se utilizan en sistemas de limpieza de lentes de contacto.
- Una vez que el sensor de presión está configurado para adquirir datos a 2 puntos/s, correr el experimento para 120 s. El sensor de presión de gas de Vernier, GPS-BTA, es recomendable para este experimento.
- Las burbujas deben ser observadas como el peróxido se descompone en agua y oxígeno gas. Libere la presión, disponga de la solución, enjuague y vuelva a colocar la solución con la siguiente solución de peróxido de hidrógeno. Repita la medición de la presión de gas hasta que se prueban todas las soluciones.
4. Análisis de datos
- Transferir todos los archivos de datos de presión versus tiempo para un programa de hoja de cálculo.
- Determinación de tasas iniciales-asumir que la concentración de peróxido de hidrógeno no ha cambiado mucho durante el corto tiempo del experimento. Los datos representan la región lineal inicial del experimento de cinética.
- Determinar pendiente trazado de presión versus tiempo y usando una pista de fórmula o lineal de la regresión. Parcela la presión en cualquier unidad común.
- La pendiente es la velocidad inicial en unidades de presión/sO2.
- Determinar el orden de reacción
- Porque la presión de evolucionada O2 es directamente proporcional a los moles de descompuesto H2O2, trazar ln (tasa inicial) vs ln [H2O2]0 produce una pendiente equivalente a la orden de la reacción. La concentración inicial del peróxido de hidrógeno, [H2O2]0, es lo que se utilizó en cada uno de los ensayos.
- La ecuación de la ley de velocidad es
 . Tomando el logaritmo natural (ln) de la ecuación produce una ecuación lineal
. Tomando el logaritmo natural (ln) de la ecuación produce una ecuación lineal  , donde m, la pendiente, es el orden de la reacción.
, donde m, la pendiente, es el orden de la reacción.
- La ecuación de la ley de velocidad es
- Porque la presión de evolucionada O2 es directamente proporcional a los moles de descompuesto H2O2, trazar ln (tasa inicial) vs ln [H2O2]0 produce una pendiente equivalente a la orden de la reacción. La concentración inicial del peróxido de hidrógeno, [H2O2]0, es lo que se utilizó en cada uno de los ensayos.
- Determinación de la tasa constante, k
- Para cada ensayo, a convertir la tasa, la PO2/s, unidades de atm/s si la tasa es en otra unidad como torr/s.
- Debido a que las burbujas fueron evolucionadas en solución acuosa, restar la presión de vapor de agua de la presión del sistema para cada ensayo. La nueva tasa refleja solamente la presión debido a la evolución de oxígeno.
- Aplicación de la ley de Gas Ideal para convertir la tasa de atm/s moles/s en cada ensayo.
- Cambiar PV = nRT n = PV/RT La s-1 unidad permanece sin cambios. El volumen es equivalente al tubo de ensayo volumen menos el volumen de solución (50 mL).
- Utilizar la reacción química balanceada para convertir de moles de oxígeno producido a moles de peróxido de hidrógeno descompuesto en cada ensayo.
- Dividir los moles de H2O2 por el volumen de la solución, 0,050 L, para obtener la molaridad de H2O2 descompuesto por segundo, [H2O2] / s.
- Porque este experimento sigue cinéticas de primer orden, divida la tasa, [H2O2] / s, por la concentración de la solución original para cada ensayo, [H2O2]0, a una tasa constante, k. Esta solución para la constante de velocidad variaría ligeramente basado en orden de la reacción determinada previamente.
- Promedio de las constantes de velocidad para cada ensayo juntos ya que la temperatura es constante.
Todas las reacciones químicas tienen una velocidad específica, que define cómo convierten los reactivos en productos.
Las reacciones químicas son gobernadas por dos factores: la cinética y termodinámica. Factores termodinámicos responsables de una reacción se producirá o no, y si absorbe o emite energía durante el proceso.
Cinética se refiere a la velocidad de una reacción química, y a qué velocidad el sistema alcanza el equilibrio. La cinética de una reacción es descrita por la ley de tipo cinético, que define la tasa basada en una constante de velocidad de reacción, la concentración de los componentes y el orden de la reacción.
Este video presenta cinética de la reacción utilizando la ecuación de la ley de tasa y demostrará cómo determinar la ley de velocidad para una cierta reacción en el laboratorio.
Para una reacción general, la velocidad de reacción es igual a la constante de velocidad de veces las concentraciones de los reactivos, cada uno elevado a un orden de reacción. La velocidad constante, k, se fija de una reacción a una temperatura determinada.
Las órdenes de reacción son independientes de los coeficientes estequiométricos. En cambio son dependientes en el mecanismo de reacción e ilustran cómo el ritmo se relaciona con la concentración de reactivos. Por ejemplo, si se ha modificado la velocidad de reacción cuando la concentración de "A" dobles, entonces la reacción no depende de la concentración y el orden es cero.
Si la tasa se duplica cuando se duplica la concentración de reactivo "A", entonces la reacción es el primer orden con respecto a "a". El mismo comportamiento vale para reactivo "B". El orden total de reacción es la suma de los órdenes de reacción individuales para cada reactivo.
Durante una reacción, la concentración de reactantes cambia con el tiempo. Tenga en cuenta que el básico ecuación no incluyen el tiempo como una variable y sólo se pueden relacionar velocidad y concentración en un punto de tiempo específico. Sin embargo, la tasa de cambios como producto de la reacción y se agotan los reactivos. Aplicando una ley diferencial de velocidad puede relacionar el cambio en la concentración a tiempo.
La ley de velocidad para una reacción se debe determinar experimentalmente, donde una reacción química es controlada cuidadosamente en una constante temperatura y la concentración de los reactantes o productos medición en intervalos de tiempo específicos. Puesto que las mediciones se hacen en puntos de tiempo discreto, la ley diferencial de velocidad es difícil correlacionar los datos experimentales.
Integrar los resultados de la ley de tasa diferencial en una ecuación más simple, llamado la ley de tarifa integrada. La ley de velocidad integrado compara las concentraciones de reactivo en el inicio de la reacción y en un tiempo especificado.
La ecuación de velocidad integrada ley varía según el orden de la reacción. Estas ecuaciones pueden tomar la forma lineal y = mx + b. Por lo tanto, una parcela de tiempo de concentración vs produce una trama lineal de una ecuación de orden cero, una parcela de la logaritmo natural del tiempo de concentración vs produce una trama lineal de una ecuación de primer orden y así sucesivamente. Ajustando los datos experimentales a estas ecuaciones, el orden de una reacción puede determinarse fácilmente. La velocidad constante, k, puede entonces ser determinado mediante la pendiente de la línea. Finalmente, las unidades de k dependen de la orden de la reacción. Cero reacción de la orden, las unidades son moles por litro por segundo, para una reacción de primer orden, las unidades son segundos inversos y para una segunda reacción de orden las unidades litros por mol por segundo.
Ahora que se han explicado los fundamentos de las leyes de la cinética de la velocidad, permite echar un vistazo a cómo determinar experimentalmente la ley de velocidad para la descomposición del peróxido de hidrógeno en agua y oxígeno.
En este experimento, se explora la descomposición catalítica del peróxido de hidrógeno sobre un catalizador de platino.
En primer lugar, prepare 5 diluciones de peróxido de hidrógeno, como se muestra en la tabla. En este caso, rango de concentraciones de 0.882 – 0,176 M, utilizando una solución stock de 0,882 M o 3%. Que las soluciones se equilibren a temperatura ambiente.
A continuación, preparar el recipiente de la reacción utilizando un tubo de ensayo. En primer lugar determinar el volumen llenando un tubo de ensayo grande en la parte superior con agua. Luego, inserte un tapón de goma 1 orificio hasta que quede apretado y agua empuja fuera del agujero por la parte superior.
Quite el tapón y vierta el agua en una probeta graduada para medir el volumen exacto. Este es el volumen de la vasija de reacción.
A continuación, verter 50 mL de la primera solución de peróxido de hidrógeno en el tubo de ensayo y luego coloque el tubo en el baño de agua de 25 ° C. Una vez equilibrado, añadir un disco de platino recubierto reacción y sella el sistema con un tapón conectado a un sensor de presión de gas.
Puesto que uno de los productos es el gas de oxígeno, el aumento de la presión en el sistema se utiliza para medir el aumento de oxígeno. Configurar el sensor de presión para adquirir datos en 2 puntos por s, y luego ejecute que el experimento de burbujas s. 120 debe verse como el peróxido se descompone en agua y oxígeno gas.
Cuando el período de reacción, libere la presión y disponer de la solución de peróxido. Enjuagar el tubo, luego llenar el tubo con la siguiente solución de peróxido de hidrógeno. Repita la medición de presión de gas para todas las soluciones.
Parcela la presión versus tiempo datos para cada solución. La presión de oxígeno desarrollada es directamente proporcional a los moles de oxígeno formado según la ley del gas ideal. Después de la reacción química, los moles de oxígeno formado pueden utilizarse para calcular los moles de peróxido de hidrógeno descompuesto. En primer lugar, asumir que la concentración de peróxido de hidrógeno no cambia significativamente durante la corta duración del experimento. Así, los datos trazados representan solamente la región inicial del experimento de cinética.
Determinar la pendiente de cada conjunto de datos mediante una regresión lineal. La pendiente es igual a la velocidad de reacción inicial en unidades de presión de oxígeno por segundo.
A continuación, parcela el logaritmo natural de la tasa de reacción inicial vs el logaritmo natural de la concentración inicial de peróxido. La pendiente es igual a la orden de la reacción, m y es aproximadamente igual a uno. Por lo tanto, la reacción es de primer orden.
La tasa para cada ensayo es en unidades de presión en Torr, por segundo. Para determinar la constante de velocidad, primero convertir la tasa en unidades de atmósferas por segundo. Porque las burbujas evolucionaron en la solución acuosa, restar la presión de vapor de agua de la presión del sistema para cada ensayo. La nueva tasa de entonces sólo refleja la presión debido a la evolución de oxígeno.
Aplicación de la ley de gas ideal para convertir la tasa de ambientes propiamente a moles por s para cada ensayo. Dos veces los moles de oxígeno producido son iguales a los moles de peróxido de hidrógeno descompuesto, según la estequiometría de la reacción química. A continuación, utilice el volumen de reacción para convertir las unidades de la tasa a la molaridad por segundo.
Determinar las constantes de velocidad para cada ensayo dividiendo la tasa en molaridad por s la concentración inicial. En este experimento, la tasa promedio constante, k, es aproximadamente 1.48 x 10-4 por s. La reacción es de primer orden, conocido desde el registro natural - parcela de logaritmo natural mostrada anteriormente. Por lo tanto, la ley de velocidad puede escribirse como se muestra.
Ahora que has visto cómo determinar la ley de velocidad para una reacción química, Veamos algunas áreas donde se aplica este concepto.
Las reacciones químicas se utilizan en la síntesis de compuestos y materiales utilizados en una amplia gama de aplicaciones científicas. Es importante entender la velocidad de reacción en estos pasos de síntesis, con el fin de controlar el progreso de una reacción.
Por ejemplo, la síntesis de nanocristales de seleniuro de cadmio y nanobarras procede a través de una serie de reacciones químicas. Cada reacción tiene su propia tarifa de la reacción discreta, y por lo tanto paso de síntesis es controlado cuidadosamente basado en la velocidad de conocimiento de la reacción; algunos lentos y algunos muy rápido.
La ley de velocidad de reacción también puede ser utilizada para describir el decaimiento radiactivo y determinar la vida media del material radioactivo. Half-Life se refiere a la cantidad de tiempo requerido para la concentración de un material caiga a la mitad de su concentración inicial.
Radiactividad sigue la cinética de primer orden, lo que significa que el tiempo necesario para que el material radiactivo a la descomposición de una caja fuerte nivel puede ser muy bien caracterizado, lo que permite el adecuado transporte y almacenamiento de residuos radiactivos y material radiactivo.
Similar a materiales radioactivos, drogas también tienen una vida media y se degradan en el cuerpo. Por ejemplo, algunos medicamentos tienen constantes de alta tasa, lo que significa que se degradan rápidamente y se debe con frecuencia. Conocimiento de este tipo de degradación permite determinar el método apropiado de la dosis, el uso y entrega.
Sólo ha visto la introducción de Zeus a velocidades de reacción. Ahora debería entender las órdenes diferentes de reacciones químicas, cómo se relacionan las tasas de reacción química y cómo determinar la ley de velocidad para una reacción química determinada en el laboratorio.
¡Gracias por ver!
Subscription Required. Please recommend JoVE to your librarian.
Results
Datos de evolución de oxígeno y tasas iniciales

Figura 1. Presión vs tiempo datos para cada ensayo a temperatura constante. La pendiente es equivalente a la tasa instantánea de la reacción.
Orden de reacción
- Datos de cinco ensayos y gráfico con pendiente se tabulan a continuación (tabla 2, figura 2). La pendiente de 0.9353 ≈ 1, es un valor entero de la orden de la reacción.

Tabla 2. Resultados de los ensayos de 5 H2O2 .

Figura 2. Parcela de logaritmo natural de concentración vs velocidad. La pendiente es equivalente a la orden de la reacción.
Constante de velocidad, k
- Calcular la tasa en mol O2/s utilizando la ley del Gas Ideal por primera restando a la presión de vapor de agua a 294 K (temperatura del experimento de cinética), 18,7 torr.
- Calcular la constante de velocidad dividiendo la tasa, [H2O2] /s por la concentración inicial de [H2O2]0.

Tabla 3. Cálculo de la tasa constante, k.
- La constante de tasa promedio 2,25 x 10-4 s-1 indica que la reacción es de primer orden en base a las unidades. La ley de velocidad puede ser reescrita como: velocidad = 2,25 x 10-4 s-1[H2O2]0
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Aunque determinar tasa ley variables puede estar implicado matemáticamente, los métodos son en realidad bastante sencillos. Como la desaparición de un reactivo o apariencia de un producto puede ser medida, tasa parcelas pueden utilizar para calcular la constante de velocidad. Una extensión de este método se utiliza con frecuencia para determinar la energía de activación de una reacción, Euna, por la tasa de medir y calcular la constante de velocidad en una variedad de temperaturas. Este método implica el uso de la ecuación de Arrhenius, k = Ae(-Ea/RT). Combinando la ley de ritmo, incluyendo el orden de reacción, con la activación energética de una reacción proporciona un perfil cinético completo para lo rápido (o lento) una reacción progresa y proporciona información del mundo real sobre cómo factores como la temperatura y concentración puede afectar esa reacción.
Cinética química encuentran aplicaciones en industrias y en campos tan variados como productos farmacéuticos, seguridad nuclear, remediación ambiental y filtros solares. Por ejemplo, un determinado medicamento puede tener una constante de velocidad muy grande, lo que significa que se descompone muy rápidamente en el cuerpo. Esto afecta a uso, dosificación y método de la entrega. Con respecto a la ciencia nuclear, radiactividad sigue la cinética de primer orden, lo que significa que el tiempo necesario para que el material nuclear a decaer a un nivel seguro es muy bien caracterizado. Las medidas serían muy similares al método presentado aquí y podrían aplicarse también a la decadencia de muchos contaminantes ambientales. Del mismo modo, filtros solares decaen también con perfiles cinéticos conocidos permitiendo a fabricantes a informar a los consumidores qué tan pronto el protector solar debe aplicarse para mantener niveles seguros.
Subscription Required. Please recommend JoVE to your librarian.
References
- Method adapted from Vetter, T. A., Colombo, D. P. Jr. Kinetics of Platinum-Catalyzed Decomposition of Hydrogen Peroxide, J. Chem. Ed. 80 (7), 788-798 (2003).
- David R. Lide, ed. CRC Handbook of Chemistry and Physics. Boca Raton, Florida: CRC Press (2005).





 . Tomando el logaritmo natural (ln) de la ecuación produce una ecuación lineal
. Tomando el logaritmo natural (ln) de la ecuación produce una ecuación lineal  , donde m, la pendiente, es el orden de la reacción.
, donde m, la pendiente, es el orden de la reacción.