Overview
Fuente: Tamara M. Powers, Departamento de química, Texas A & M University
Mientras más moléculas son diamagnéticos, en donde todos sus electrones se aparean para arriba en bonos, muchos complejos de metales de transición son paramagnéticos, que tiene fundamento Estados con electrones no apareados. Recordar la regla de Hund, que dice que para orbitales de energías similares, electrones llenarán los orbitarios para maximizar el número de electrones no apareados antes de emparejar para arriba. Metales de transición parcialmente han poblado d-orbitarios cuyas energías están perturbados en diversos grados por la coordinación de los ligandos al metal. Así, los d-orbitarios son similares en energía uno al otro, pero no son todos degenerados. Esto permite complejos diamagnéticos, con todos los electrones en pareja o paramagnética, con electrones no apareados.
Conocer el número de electrones no apareados en un complejo de metal puede proporcionar pistas en el estado de oxidación y geometría de lo complejos del metal, así como en la fuerza de (campo de cristal) del campo de ligando de los ligandos. Estas propiedades afectan grandemente la espectroscopia y la reactividad de complejos de metales de transición y son tan importantes para entender.
Una forma de contar el número de electrones no apareados es para medir la susceptibilidad magnética χ, del compuesto de coordinación. Susceptibilidad magnética es la medida de la magnetización de un material (o compuesto) cuando coloca en un campo magnético aplicado. Electrones apareados son levemente repelidos por un campo magnético aplicado, y esta repulsión aumenta linealmente a medida que la fuerza del campo magnético aumenta. Por otro lado, electrones desparejados son atraídos (a un grado más grande) a un campo magnético, y la atracción aumenta linealmente con la fuerza del campo magnético. Por lo tanto, cualquier compuesto con electrones no apareados se ser atraído por un campo magnético. 1
Cuando se mide la susceptibilidad magnética, obtenemos información sobre el número de electrones no apareados de momento magnético μ. La susceptibilidad magnética se relaciona con el momento magnético, μ ecuación 12:
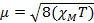 (1)
(1)
La constante 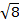 = [(3kB) / Nβ2)], donde β = magneton de Bohr del electrón (0.93 x 10-20 erg gauss-1), N = número de Avogadro y kB = constante de Boltzmann
= [(3kB) / Nβ2)], donde β = magneton de Bohr del electrón (0.93 x 10-20 erg gauss-1), N = número de Avogadro y kB = constante de Boltzmann
XM = susceptibilidad magnética molar (cm3/mol)
T = temperatura (K)
μ = momento magnético, medido en unidades de magneton de Bohr, μB = 9.27 x 10-24 JT-1
El momento magnético de complejos está dada por la ecuación 21:
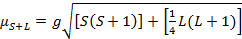 (2)
(2)
g = cociente gyromagnetic = 2.00023 μB
S = Número cuántico de spin = ∑ms = [número de electrones no apareados, n] / 2
L = Número cuántico orbital = ∑ml
Esta ecuación tiene contribuciones de orbital y de spin. Para los complejos de metales de transición de primera fila, la contribución orbital es pequeña y por lo tanto, puede omitirse, por lo que el momento magnético de spin sólo se da por ecuación 3:
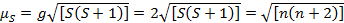 (3)
(3)
El momento magnético de spin sólo así puede dar directamente el número de electrones no apareados. Esta aproximación puede hacerse también para los metales más pesados, aunque orbitales contribuciones pueden ser significativas para los metales de transición de segunda y tercera fila. Esta contribución puede ser tan significativa que infla el momento magnético suficientemente que el compuesto parece más han desapareado electrones que lo hace. Por lo tanto, la caracterización adicional puede ser necesario para estos complejos.
En este experimento, el momento magnético de solución de tris(acetylacetonato)iron(III) (Fe(acac)3) se determina experimentalmente mediante método de Evans en cloroformo.
Principles
Hay muchos métodos para medir la susceptibilidad magnética. En los finalesdel siglo 19, Louis Georges Gouy desarrolló la balanza de Gouy, que es un método muy preciso para medir la susceptibilidad magnética. En este enfoque, una balanza analítica se utiliza para masa un imán y el cambio de masa observada en colocar una muestra paramagnética entre los polos del imán está relacionada con la susceptibilidad magnética. Este método no es práctico, como suspender la muestra entre los polos del imán no es trivial. Esto requiere cuatro mediciones de masa entre que no se puede mover el imán y para las muestras sensibles al aire, esta medición debe llevarse a cabo dentro de una guantera. Saldos de susceptibilidad magnética más modernos están disponibles, pero esto requiere la compra de tal equilibrio.
Otro método es utilizar un magnetómetro SQUID (dispositivo de interferencia cuántica superconductora). Esto requiere varios mg de muestra sólida y a menos que otras mediciones magnéticas deben realizarse en la muestra, no es práctico ni rentable para los complejos paramagnéticos que pueden hacerse en soluciones.
Por último, y lo que se demostrará aquí, es el uso de un espectrómetro de RMN para medir la susceptibilidad magnética. Este enfoque fue desarrollado por Dennis Evans en 1959. Es sencillo y se basa en el efecto que paramagnet en solución tiene en el cambio químico de un compuesto de referencia, generalmente el solvente. Recolección de datos puede hacerse en cualquier espectrómetro de RMN, los datos son fáciles de interpretar, y preparación de la muestra es sencilla y requiere poco material. Se ha convertido en el método estándar para obtener datos de susceptibilidad magnética para los complejos inorgánicos.
La medición de susceptibilidad magnética por el método de Evans se basa en el hecho de que los electrones no apareados de la paramagnet en la solución resultará en un cambio de la cambio química de todas las especies en solución (figura 1). Así, observando la diferencia de cambio química de una molécula de solvente en presencia y en ausencia de una especie paramagnética, la susceptibilidad magnética se puede obtener mediante la ecuación 4 (para un espectrómetro de RMN de alto campo)3
 (4)
(4)
Δf = diferencia de la frecuencia en Hz entre la resonancia cambiada de puesto y la resonancia de solvente pura
F = espectrómetro radiofrecuencia en Hz
c = concentración de especies paramagnéticas (mol/mL)
Datos se obtienen fácilmente por la recogida de un espectro de 1H NMR de una muestra que contiene un capilar de solvente puro, con una solución de la paramagnet que rodea el tubo capilar dentro del tubo NMR (figura 2).

Figura 1. Ejemplo 1H NMR espectro del experimento

Figura 2. Imagen de un tubo capilar en la configuración de tubo NMR
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. preparación del relleno capilar
- Utilizando una llama de gas más ligero o de otro, se funden la punta de una pipeta Pasteur largo. Gire suavemente la punta de la pipeta en la llama hasta la forma de una bombilla pequeña. Deje que el vidrio se enfríe.
- En un vial de centelleo, preparar una solución de 50: 1 (volumen) de deuterados: proteo cloroformo. Pipeta 2 mL de disolventes deuterados y a esto agregar 40 μl de disolvente de proteo. Tapa el frasco.
- Cuidadosamente añadir unas gotas de la mezcla solvente a la pipeta de cristal. Suavemente mueva la punta de la pipeta sellada para que el líquido entra en el capilar. Repita hasta que la solución tiene una profundidad de ~ 2 pulgadas desde la parte inferior del tubo capilar. Asegúrese de que no hay ningunas burbujas de aire.
- Tapa de la pipeta con un septum de goma de 14/20. Utilizando una jeringa de 3 mL con una aguja, inserte la aguja en la pipeta y extraer 3 mL de aire. Esto crea un vacío parcial, facilitar el siguiente paso.
- Selle la parte superior del tubo capilar. Horizontalmente la pipeta en un soporte de anillo de la abrazadera. Utilizar un encendedor para ablandar el vidrio encima de la solución en la parte inferior de la pipeta. Una vez que el cristal, comienza a girar la punta de la pipeta y tire de la punta de la pipeta de la base sujeta. Deje enfriar del capilar sellado.
2. preparación de solución paramagnética
- Utilizando una balanza analítica, la masa un vial de centelleo y la tapa. Tenga en cuenta la masa.
- Masa hacia fuera 5-10 mg de Fe(acac)3 en el vial de centelleo y anote la masa. Fe(AcAc)3 tiene un momento magnético de solución muy alta. Por lo tanto 5-10 mg va a generar un gran cambio de la cambio química. Por lo general, 10-15 mg es una masa más apropiada a utilizar para las muestras método de Evans.
- Pipetee ~ 600 μl de la mezcla solvente preparada en el frasco que contiene la especie paramagnética. Tapa el frasco y tenga en cuenta la masa. Asegúrese de que el sólido disuelve totalmente.
3. preparación de muestra de RMN
- En un tubo estándar de NMR, caer cuidadosamente el inserto capilar en un ángulo, para no romperlo.
- Pipeta en la solución que contiene la especie paramagnética.
- Cerrar el tubo NMR. Para las muestras sensibles al aire, envolver Parafilm alrededor de la tapa.
4. recopilación de datos
- Adquirir y guardar un estándar 1H NMR espectro.
- Tenga en cuenta la temperatura de la sonda.
- Tenga en cuenta la radiofrecuencia.
5. resultados y análisis de datos
- La masa y la densidad del solvente, calcular el volumen del disolvente utilizado para preparar la solución paramagnética.
- Calcular la concentración (M) de la solución paramagnética.
- Calcular la separación del pico de la resonancia solvente entre el solvente puro (en el capilar) y cambiado de puesto por el paramagnet (fuera de los capilares) (Δppm). Si esto se hace en ppm, convertirlo en Hz por la ecuación 5:
 (5)
(5)
F = espectrómetro radiofrecuencia en Hz - Calcular la susceptibilidad magnética, utilizando la ecuación 4.
- Calcular el momento magnético usando la ecuación 1.
- Comparar el momento magnético obtenido con que predijo para números electrones no apareados de la ecuación 3. La susceptibilidad magnética será ligeramente mayor que el valor esperado de sólo vuelta indicado en la tabla, pero debe ser menor que la que corresponde a n + 1 electrones desparejados.
- Dar el número de electrones no apareados para la especie paramagnética.
6. solución de problemas
- Si no se observan dos picos bien resueltos de disolvente, haga lo siguiente:
- Utilizar un espectrómetro con una mayor intensidad de campo para aumentar la diferencia de cambio químico (en ppm) de los dos picos.
- Hacer la muestra más concentrada, por lo que el cambio es más grande.
- A veces el valor no tiene sentido. Si se obtiene un valor que es demasiado bajo, haga lo siguiente:
- Repito, teniendo mayor cuidado en la formación hacia fuera la especie paramagnética y disolvente.
- Asegúrese de que la especie paramagnética se utiliza es pura. Incluso solventes impurezas en cristales afectarán a la masa y por lo tanto, concentración.
- Para moléculas grandes, el diamagnetismo puede ser tan importante que debe hacerse una corrección diamagnético. Este término se resta a ecuación 4:

- A veces el valor no tiene sentido. Si se obtiene un valor que es demasiado alto, haga lo siguiente:
- Siga los mismos pasos que 6.2.1-6.2.3.
- Para los metales más pesados, inclusión de aportaciones orbitales puede ser necesario.
7. aire-sensibles muestras
- Las muestras de aire-sensible pueden analizarse fácilmente usando esta técnica. Pasos 1.2-1.4, paso 2 y paso 3 simplemente se llevan a cabo dentro de una caja de guante.
El método de Evans es una técnica para calcular el número de electrones no apareados en complejos metálicos de la solución de estado.
Muchos complejos de metales de transición han desapareado electrones, lo que atrajo a los campos magnéticos. Estos complejos se denominan paramagnéticos. Complejos con todos los electrones apareados se llaman diamagnéticos.
Saber el número de electrones no apareados es importante para predecir la reactividad de un compuesto. El método de Evans utiliza espectroscopía de RMN para medir los parámetros necesarios para calcular el número de electrones no apareados.
Este video se ilustran el procedimiento para realizar el método de Evans, demostrar el análisis de Fe(acac)3e introducir unas cuantas aplicaciones de conteo de electrones desparejados en química.
El número de electrones no apareados en un complejo puede determinarse desde el momento magnético de la molécula dada. Los momentos magnéticos de complejos de metales de transición 1st fila pueden ser aproximados de las contribuciones de electrones desparejados, llamados el momento magnético de spin sólo. Para el 2º y complejos de metales de transición de fila 3rd , debe considerarse la vuelta y la contribución orbital.
El momento magnético se relaciona con la susceptibilidad magnética, que proporciona el grado de magnetización de un complejo en un campo magnético aplicado.
El cambio químico de una especie en un espectro de RMN es afectada por la susceptibilidad magnética en general de la solución de la muestra. Así, el producto químico cambio de disolvente cambia si el soluto es paramagnético.
Un ejemplo de método de Evans utiliza un inserto capilar que contiene una mezcla de un solvente deuterado y el solvente de proteated correspondiente. El compuesto de interés es disuelto en la misma mezcla de solventes y colocado en un tubo NMR con el tubo capilar.
El espectro de RMN adquirido muestra dos picos solvente: correspondiente al proteated solvente en solución con el compuesto y el otro correspondiente al proteated solvente en el tubo capilar.
La susceptibilidad magnética se calcula de la diferencia de la frecuencia y la concentración del compuesto paramagnético en la muestra.
El momento magnético se calcula de la susceptibilidad magnética en una unidad especial llamada el magneton de Bohr. El momento magnético entonces puede ser comparado con valores teóricos de vuelta sólo para estimar el número de electrones no apareados en la muestra.
Ahora que usted entiende los principios del método de Evans, vamos a ir a través de un procedimiento para encontrar el número de electrones no apareados en el Fe(acac)3 con el método de Evans.
Para preparar el relleno capilar, fundir la punta de una pipeta Pasteur largo con una llama hasta que la punta se funde en un bulbo de cristal. Deje que el vidrio se enfríe.
A continuación, se combinan en un vial de centelleo limpio 2 mL de un solvente deuterado y 40 μL de disolvente de proteated. Tapa el frasco y agitar suavemente.
Cuidadosamente añadir unas gotas de la mezcla solvente a la pipeta refrescada. Suavemente mueva o toque la punta de la pipeta hasta que el disolvente ha reunido en la parte inferior de la punta.
Seguir añadiendo la mezcla de solventes de esta manera hasta que la solución llena la pipeta sellada a una profundidad de aproximadamente 2 pulgadas, con sin burbujas de aire.
Tapa de la pipeta con un septum de goma de 14/20. Equiparse con una jeringa de 3 mL con una aguja. Inserte la aguja a través del tabique y retirar cuidadosamente 3 mL de aire.
Retire la jeringa y la pipeta en un soporte de anillo de la abrazadera horizontal. Utilizar un encendedor para ablandar el vidrio encima de la solución en la punta de la pipeta.
Una vez que el cristal comienza a ablandar, gire lentamente la punta de la pipeta llena de solución para sellar en la solución. Continuar girando el capilar recién formada hasta que fácilmente se separa del cuerpo de la pipeta.
Deje enfriar el relleno capilar y luego guardarlo en un recipiente etiquetado.
Para preparar una muestra para el método de Evans, registrar primero la masa de un vial de centelleo y un casquillo. Luego, coloque 5 mg del compuesto paramagnético de interés en el vial de centelleo y registrar la masa.
Pipeta sobre 600 μL de la mezcla de deuterados y proteated solventes en el centelleo del frasco. Agitar el frasco hasta que el compuesto sólido se disuelva completamente.
Registrar la masa del frasco tapado de solución de la muestra. A continuación, obtener un tubo estándar de NMR y la tapa.
Deslice con cuidado el relleno capilar en el tubo NMR en ángulo. Transferir la solución del compuesto paramagnético al tubo NMR y la tapa del tubo. Asegúrese de que el inserto está sentado en la parte inferior del tubo.
Adquirir y guardar un estándar 1H NMR espectro.
En primer lugar, calcular la concentración de la solución de la muestra en moles por centímetro cúbico utilizando las masas grabadas y la densidad del solvente. A continuación, convierte la diferencia entre los desplazamientos químicos de pico solvente de ppm a Hz. calcular la susceptibilidad magnética molar de la muestra.
A continuación, calcular el momento magnético de la temperatura de la sonda y la susceptibilidad magnética molar. Comparar el valor calculado con una tabla de valores conocidos para determinar el número de electrones no apareados en el compuesto.
El número de electrones no apareados es importante para el modelado de complejos químicos y biológicos. Echemos un vistazo a unas cuantas aplicaciones.
Complejos de metales de transición pueden ser modelados con teoría orbital molecular. En este modelo, los electrones se asignan a orbitales moleculares compartidos entre los átomos. Información sobre el número de electrones no apareados ayuda a confirmar que se está utilizando un modelo apropiado. Además, el número de orbitales por separado ocupadas y desocupadas predice cómo va a reaccionar el complejo con otras moléculas.
Las moléculas se pueden clasificar por las operaciones de simetría que pueden realizar, como se refleja a través de un eje. Simetría molecular puede predecir muchas propiedades, tales como los modos de vibración de un compuesto. Como el número de electrones no apareados puede proporcionar información sobre Geometría molecular, es importante determinar con exactitud el número de electrones no apareados al caracterizar compuestos.
Sólo ha visto la introducción de Zeus para el método de Evans. Ahora usted debe entender los principios del método de Evans, el procedimiento para calcular el número de electrones no apareados y cómo desapareados electrones son relevantes para la comprensión de la reactividad química. ¡Gracias por ver!
Subscription Required. Please recommend JoVE to your librarian.
Results
E xperimental resultados
| Fe(AcAc)3 | Cloroformo | |
| m (g) | 0.0051 | 0.874 |
| MW (g/mol) | 353.17 | n / a |
| n (mol) | 1.44⋅10-5 | n / a |
| Densidad (g/mL) | n / a | 1.49* |
| Volumen (mL) | n / a | 0.587 |
| c (mol/mL) | 2.45⋅10-5 | |
| NMR cambios | Pico 1 | Pico 2 |
| Δ (ppm) | 7.26 | 5.85 |
| Δppm | 1.41 | |
| Instrumento de RMN | ||
| Temperatura (K) | 296.3 | |
| Campo, F (Hz) | 500⋅106 |
* la densidad del solvente se puede aproximar a la densidad del disolvente utilizado
Cálculos:

 = 0,0137 cm3/mol
= 0,0137 cm3/mol
 = 5.70 μ B
= 5.70 μ B
Resultados teóricos para S y valores n:
| S | n | Μ S |
| 1/2 | 1 | 1.73 |
| 1 | 2 | 2.83 |
| 3/2 | 3 | 3.87 |
| 2 | 4 | 4.90 |
| 5/2 | 5 | 5.92 |
4,5 mg de Fe(acac)3 disuelto en solvente 0,58 mL, con un instrumento de 300 MHz se observa una separación máxima de 1,41 ppm, que da XM= 1.37 x 10-2 y μeff = 5.70. Este valor de μeff es consistente con una S = 5/2 complejo, que tiene 5 electrones no apareados.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
El método de Evans es un método simple y práctico para la obtención de la susceptibilidad magnética de complejos metálicos solubles. Esto proporciona el número de electrones no apareados en un metal complejo, que es pertinente a la espectroscopía, propiedades magnéticas y reactividad del complejo.
Medición de la susceptibilidad magnética de especies paramagnéticas da el número de electrones no apareados, que es una propiedad clave de complejos metálicos. Como la reactividad de complejos metálicos está influenciada por su estructura electrónica - es decir, cómo se rellenan los d-orbitarios - es importante establecer el número de electrones no apareados. La susceptibilidad magnética puede utilizarse para determinar la geometría del metal en solución, dan la penetración en la fuerza del campo ligando y puede proporcionar la evidencia para la correcta asignación de estado de oxidación formal de metal complejo. En los módulos de "Grupo teoría" y "Teoría de la MO de complejos de metales de transición", presentaremos cómo predecir diagramas división d-orbital así como utilizar los datos por el método de Evans para ayudar a determinar la geometría de un metal complejo y proporcionan la evidencia para la Estado de oxidación del centro metálico.
Hay varios instrumentos que pueden utilizarse para medir la susceptibilidad magnética de una especie paramagnética incluyendo una balanza de Gouy, calamar, o instrumento NMR. El método de Evans es una técnica sencilla y práctica que NMR se utiliza para determinar el momento magnético de solución de un paramagnet. Mientras que el método de Evans es una potente herramienta en el campo del magnetismo, hay varios inconvenientes a la técnica. En primer lugar, la molécula debe ser soluble en el solvente utilizado en el experimento. Si la muestra paramagnética no se haya disuelto completamente, la concentración de la solución será incorrecta, que conducirá a errores en el momento de magnético determinado experimentalmente de la solución. Otros errores en la concentración pueden surgir si dispone de la muestra paramagnética diamagnético (solvente) o impurezas paramagnéticas.
Subscription Required. Please recommend JoVE to your librarian.
References
- Miessler, G. L., Fischer, P. J., Tarr, D. A. Inorganic Chemistry. 5 ed. Pearson. (2014).
- Drago, R. S. Physical Methods for Chemists. 2 ed. Saunders College Publishing. (1992).
- Girolami, G. S., Rauchfuss, T. B., Angelici, R. J. Synthesis and Technique in Inorganic Chemistry: A Laboratory Manual. 3 ed. University Science Books. Sausalito, CA, (1999).





 (5)
(5)