Overview
Quelle: Meunier Sylvain1,2,3, Perchet Thibaut1,2,3, Sophie Novault4, Rachel Golub1,2,3
1 Einheit für Lymphopoiese, Institut für Immunologie, Pasteur Institute, Paris, Frankreich
2 INSERM U1223, Paris, Frankreich
3 Université Paris Diderot, Sorbonne Paris Cité, Cellule Pasteur, Paris, Frankreich
4 Flow Cytometry Platfrom, Cytometry and Biomarkers UtechS, Center for Translational Science, Pasteur Institute, Paris, Frankreich
Die Abwehr von Krankheitserregern hängt von der Überwachung durch das Immunsystem ab. Dieses System ist komplex und umfasst viele Zelltypen, von denen jeder spezifische Funktionen hat. Diese komplexe Zusammensetzung ermöglicht Immunreaktionen auf eine große Vielfalt von Krankheitserregern und Verletzungen. Die adaptive Immunität ermöglicht spezifische Reaktionen gegen bestimmte Krankheitserreger. Die Mehrheit der Zellen, die für diese Art der Immunität verantwortlich sind, sind die Lymphozyten (B-Zellen und T-Zellen). In der Regel reagieren B-Zellen auf extrazelluläre Infektionen (z. B. bakterielle Infektionen) und T-Zellen auf intrazelluläre Infektionen (z. B. Virusinfektionen). Die verschiedenen Zelltypen in Lymphozytenpopulationen können durch die Kombination von Zelloberflächenproteinen, die sie exprimieren, und/oder durch eine Gruppe von abgesonderten Zytokinen charakterisiert werden.
Die magnetische Sortierung ermöglicht die Anreicherung von Zielzellpopulationen unter Verwendung magnetischer Eigenschaften und expressionierung eines oder mehrerer Zelloberflächenproteine (1, 2). Diese Technik besteht aus drei Schritten. Zunächst werden die Zellen mit magnetischen Perlen inkubiert, die mit einem oder mehreren monoklonalen Antikörpern gekoppelt sind. Zellen, die Oberflächenproteine ausdrücken, die an diese Antikörper binden, heften sich an die magnetischen Perlen. Dann werden die Zielzellpopulationen mit einem Magneten erfasst. Zum Abschluss werden die Zielzellen vom Magneten eluiert. Am Ende werden zwei Sortierprodukte erhalten, eines mit nicht beschrifteten Zellen und das zweite mit den Zielzellen gekoppelt mit den Magnetperlen. Säulen können verwendet werden, um die Effizienz der magnetischen Sortierung zu verbessern. In der Spalte verlängert ein nichtmagnetisches Element den Pfad der Zelle durch die Spalte. Daher wird der Zellfluss verlangsamt, was die Zellerfassung durch den Magneten erleichtert.
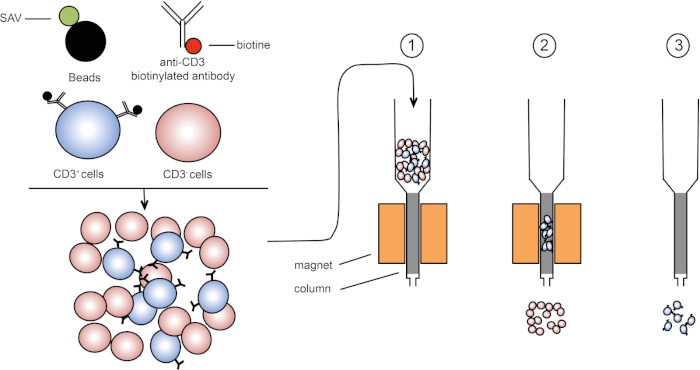
Abbildung 1: Schematische Darstellung der magnetischen Trennung. Thymische Leukozyten sind mit Anti-CD3-biotinylierten Antikörpern gefärbt. Nach dem Waschen fixieren Streptavidin (SAV) gekoppelte Perlen das Biotin gezielt auf Anti-CD3-Antikörper. (1) Zellen werden in eine Spalte übertragen. (2) Der Magnet behält keine unbeschrifteten Zellen, während CD3-positive Zellen in der Spalte verbleiben. Schließlich wird die Säule vom Magneten getrennt und (3) CD3-positive Zellen werden im Medium eluiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Es gibt zwei Arten der magnetischen Sortierung (3). Bei der positiven Sortierung werden Von interessede Zellen mit den Magnetperlen erfasst. Bei der negativen Sortierung werden unerwünschte Zellen entfernt, indem sie mit den magnetischen Perlen, die die entsprechenden Antikörper tragen, aufgenommen werden. Diese MACS-Technik ermöglicht eine gute Anreicherung von Zielzellen und verbessert den Anteil der zurückgewonnenen Zellen von 1-20% auf 60-98% in einem Organ. Nach der Sortierung ist es notwendig, die Zellreinheit und die Sortierung nach verschiedenen Methoden (z.B. Durchflusszytometrie) zu überprüfen. Die MACS-Technik ist ideal, um eine Zielpopulation für andere Experimente wie Zellkultur oder Zellzyklusanalyse zu bereichern.
In dieser Übungseinheit zeigen wir, wie thymische Leukozyten isoliert und anschließend thymische CD3-positive Zellen aus dem Mix mit der magnetischen Zellsortierungstechnik angereichert werden können.
Procedure
1. Vorbereitung
- Vor Beginn Laborhandschuhe und entsprechende Schutzkleidung anziehen.
- Waschen Sie alle Sezierwerkzeuge, zuerst mit einem Waschmittel und dann mit 70% Ethanol und trocknen Sie sie dann mit einem sauberen Papiertuch.
- Bereiten Sie 200 ml von Hanks ausgewogener Salzlösung (HBSS) vor, die 2% fetales Kalbsserum (FCS) enthält.
2. Dissektion
- Pin eine eingeschläferte Maus auf eine Sezierplatte in der Supine-Position.
- Mit Schere und Zange führen Sie eine Längs-Laparotomie durch, um auf die Brusthöhle zuzugreifen.
- Entfernen Sie das Herz, um Zugang zum Thymus zu erhalten, der sich über dem Herzen befindet. Identifizieren Sie dann den Thymus, der aus zwei weißen Lappen besteht und sich in der Brusthöhle über dem Herzen befindet.
- Mit Zangen den Thymus vorsichtig lösen und auf die Petrischale mit 5 ml HBSS 2% FCS legen.
3. Immunzellisolierung
- Legen Sie den Thymus auf ein 40-m-Zellsieb über die gleiche Petrischale. Crush den Thymus mit einem Kolben, um es in der gleichen Schale zu dissoziieren.
- Den dissoziierten Thymus und die Flüssigkeit in ein 15 ml Zentrifugenrohr übertragen.
- Die Petrischale mit 5 ml HBSS 2% FCS waschen und das gewaschene Medium auch in das gleiche Zentrifugenrohr übertragen.
- Zentrifugieren Sie das Rohr bei 370 x g für 7 min bei 20°C und entsorgen Sie den Überstand, um das Pellet zu vermeiden.
- Das Pellet in 2 ml Kaliumacetat wieder aufsetzen, um die Erythrozyten zu lysieren. Warten Sie 2 min und machen Sie dann das Volumen bis zu 14 ml mit HBSS 2% FCS.
- Zentrifugieren Sie das Rohr wieder bei 370 x g für 7 min bei 20°C. Entsorgen Sie den Überstand und setzen Sie das Pellet in 5 ml HBSS 2% FCS wieder aus.
- Schätzen Sie die Zellkonzentration mit dem Trypan-Blau-Färbe-Assay und passen Sie die endgültige Zellkonzentration auf 107 Zellen/ml mit einem entsprechenden Volumen von HBSS 2% FCS an.
4. Magnetische Kennzeichnung von Immunzellen
- Nehmen Sie zwei FACS-Rohre. Beschriften Sie eine Röhre, "nicht angereicherte T-Zellen", und die andere Röhre, "angereicherte T-Zellen" - die durch magnetische Beschriftung getrennt werden.
- Verteilen Sie die Zelllösung in jede der beiden FACS-Röhren.
- Zentrifugieren Sie das "angereicherte T-Zellen"-Rohr bei 370 x g für 3 min bei 20°C und entsorgen Sie den Überstand, der das Pellet vermeidet.
- Setzen Sie das Pellet in 250 l biotinylierten Antikörpern gegen CD3 aus (Tabelle 1, Mix 1).
| mischen | Etikettierungsreagenzien | verdünnung |
| 1 | Anti-CD3 biotinylierter Antikörper | 1/400 (in HBSS 2% FCS) |
| 2 | Streptavidin gekoppelte Perlen | 1/5 (in HBSS 2% FCS) |
| 3 | Anti-CD3 BV421 | 1/200 (in HBSS 2% FCS) |
Tabelle 1: Antikörper mischen Zusammensetzung. Für die magnetische Trennung werden die Mischungen 1 und 2 verwendet. Mix 3 wird zur Bewertung der Zellanreicherung nach magnetischer Trennung verwendet.
- Die Zellsuspensions-Antikörper-Mischung 15 Minuten bei 4°C im Dunkeln inkubieren.
- Fügen Sie 3 ml HBSS 2% FCS in die Rohre und zentrifugieren Sie sie wieder bei 370 x g für 3 min bei 20°C.
- Entsorgen Sie den Überstand und setzen Sie das Pellet in 250 L Streptavidin-gekoppelten Perlen wieder auf (Tabelle 1, Mix 2).
- Die Zellmischung und perlen 20 min auf Eis bebrüten.
- Als nächstes fügen Sie 3 ml HBSS 2% FCS hinzu und mischen Sie gut und Zentrifuge wieder bei 370 x g für 3 min bei 20°C.
- Setzen Sie das Pellet in 2 ml HBSS 2% FCS aus.
5. Magnetische Trennung von CD3-positiven Zellen
- Legen Sie die Säule auf den Magneten und fügen Sie 3 ml HBSS 2% FCS hinzu, um das System zu befeuchten. Warten Sie 5 Minuten.
- Pipetten Sie anschließend die beschrifteten Zellen in die Spalte.
- Nachdem die Zellsuspension durch die Säule geht, waschen Sie die Säule X3 mal mit 3 ml HBSS 2% FCS.
- Entfernen Sie dann die Säule vom Magneten und legen Sie sie in ein 15 ml Sammelrohr.
- Um die Zielzellen zu löschen, fügen Sie der Spalte 5 ml HBSS 2% FCS hinzu und spülen Sie die Spalte mit dem Kolben.
- Wiederholen Sie den Elutionsschritt mit einem weiteren 5 ml HBSS 2% FCS.
6. Bewertung der Target-Cell-Anreicherung durch Durchflusszytometrie
- Übertragen Sie 500 l eluierte Zellsuspension in ein FACS-Rohr mit der Bezeichnung "angereicherte T-Zellen". Übertragen Sie 200 L der Suspension "nicht angereicherter T-Zellen" auf eine zweite FACS.
- Dann zentrifugieren beide Rohre bei 370 x g für 7 min bei 20°C.
- Entsorgen Sie den Überstand, und fügen Sie beiden Röhren 100 l fluoreszierenden Antikörper Mix 3 (siehe Tabelle 1) hinzu.
- Inkubieren Sie beide Rohre für 20 min bei 4°C im Dunkeln.
- Als nächstes fügen Sie 3 ml HBSS 2% FCS zu den Röhren hinzu und zentrifugieren Sie sie bei 370 x g für 3 min bei 20°C.
- Entsorgen Sie den Überstand, und setzen Sie dann jedes Rohr in 250 l HBSS 2% FCS wieder aus.
- Bewerten Sie nun die CD3-positive Zellanreicherungsrate durch Durchflusszytometrie.
7. Datenanalyse
- Öffnen Sie das "FlowJo"-Symbol und ziehen Sie die Dateien für jede Röhre im Fenster"Alle Beispiele".
- Doppelklicken Sie auf die Datei "angereicherte T-Zellen", um das Punktdiagramm anzuzeigen, das die Vorwärtsstreuung (FSC-A) auf der X-Achse und die Seitenstreuung (SSC-A) auf der Y-Achse anzeigt.
- Klicken Sie auf "Polygon", um die Lymphozytenpopulationen zu umkreisen.
- Doppelklicken Sie anschließend auf die eingekreiste Grundgesamtheit, um ein neues Fenster zu erstellen.
- Wählen Sie "FSC-W" auf der Y-Achse und "FSC-A" auf der X-Achse und kreisen Sie die FSA-W-Negativzellen. Benennen Sie im Fenster "Subpopulation identification" die Zellpopulation als "einzelzellen".
- Doppelklicken Sie auf die eingekreiste Bevölkerung, um ein neues Fenster zu erstellen. Wählen Sie "CD3" auf der Y-Achse aus, und kreisen Sie die CD3-positiven Zellen. Benennen Sie im Fenster "Subpopulation identification" Ihre Zellenpopulation "T-Zellen".
- Wiederholen Sie dies mit den "nicht angereicherten T-Zellen".
- Um die Zellpopulation zu visualisieren, klicken Sie auf"Layout-Editor" und ziehen Sie die "T-Zellen"-Populationaus "angereicherten T-Zellen" und "nicht angereicherten T-Zellen"-Dateien in die Registerkarte.
- Punktdiagramme, die CD3+ Lymphozyten darstellen, werden angezeigt. CD3+-Zellen sollten nur in der Population von Interesse in der CD3+ angereicherten Röhre erscheinen.
- Um die Anreicherung von CD3+-Lymphozyten in den sortierten Zellen auszuwerten, klicken Sie auf"Tabelleneditor", und ziehen Sie dann die "T-Zellen"-Population aus den Dateien "angereicherte T-Zellen" und "nicht angereicherte T-Zellen" in die Tabelle.
- Wählen Sie im Menü "Statistik" zellen "Häufigkeit von Lymphozyten" aus, um den Prozentsatz der CD3+-Zellen in allen Lymphozyten zu überprüfen, und klicken Sie dann auf " Tabelleerstellen".
- Parameterwerte werden in einer neuen Tabelle angezeigt. Bei den "angereicherten T-Zellen" sollte die Frequenz der CD3+-Zellen bei etwa 80 % liegen.
Die magnetisch aktivierte Zellsortierung (MACS) ist eine Technik, die es Forschern ermöglicht, Zellen auf der Grundlage spezifischer Epitope, die auf ihren Oberflächen exprimiert werden, zu trennen.
Der Prozess beginnt in der Regel mit der Extraktion eines Organs oder Gewebes, wie dem Thymus. Dann werden die Zellen mechanisch getrennt, in der Regel durch Zerkleinern, bis das Gewebe in einzelne Zellen zerlegt wird. Unerwünschte Zellen können in diesem Stadium durch Zugabe von Chemikalien entfernt werden. Zum Beispiel kann Ammoniumchlorid-Kalium oder ACK-Puffer verwendet werden, um unerwünschte Erythrozyten zu lysieren.
Als nächstes wird der Suspension ein Antikörper hinzugefügt, der mit einem Molekül namens Biotin konjugiert wird, und diese Komplexe binden an die Epitope der Oberfläche der Zielzellen. Biotin hat eine hohe Affinität zu einem anderen Molekül namens Streptavidin. Im nächsten Schritt werden den Antikörper-markierten Zellen Streptavidin-Moleküle zu magnetischen Perlen hinzugefügt. Wenn Biotin und Streptavidin in Kontakt kommen, binden sie fest. Das Ergebnis ist, dass die Interessenszellen mit magnetischen Perlen beschichtet sind. Dieser Komplex wird manchmal als Sandwich bezeichnet. In diesem Fall, CD3 auf der Zellmembran auf der Unterseite, dann Anti-CD3 konjugiert zu Biotin, und schließlich, Streptavidin konjugiert zu magnetischen Perlen.
Diese beschrifteten Zellen können nun in eine Spalte mit einer Matrix platziert werden, die, unterstützt durch die Schwerkraft, die Zellen langsam durch einen Magneten passieren lässt. Dabei kleben die magnetischen, mit Perlen beschrifteten Zellen am Rand des Rohres, das dem Magnet am nächsten liegt, während die nicht beschrifteten Zellen in einem Sammelrohr weitergeführt werden. Als nächstes können die beschrifteten Zellen aus der Säule entfernt werden, indem sie einfach den Magneten entfernen, eine Eluentenlösung hinzufügen und sanften Druck mit einem Kolben anwenden, um sie aus der Säule in ein frisches Sammelrohr zu spülen. Letztlich ermöglicht dieser Prozess 60 bis 98% Abruf der Zellen von Interesse.
In diesem Verfahren werden wir thymische Leukozyten von einer Maus isolieren und MACS verwenden, um CD3-positive T-Zellen zu sortieren, bevor wir die Effizienz der Sortierung mit FACS bestätigen.
Zunächst sollten Sie alle geeigneten Schutzausrüstungen einschließlich Labormantel und Handschuhe anziehen. Als nächstes waschen Sie eine Schere und Zange mit 70% Ethanol und trocknen Sie sie mit einem sauberen Papiertuch. Dann bereiten 200 Milliliter HBSS 2% fetale Kalbsserum, oder FCS, durch Mischen von vier Milliliter FCS mit 196 Milliliter HBSS.
Pin eine eingeschläferte Maus in einer Supine-Position auf einer Sezierplatte. Führen Sie mit Schere und Zange eine Längs-Laparotomie durch, um auf die Brusthöhle zuzugreifen. Entfernen Sie zuerst das Herz, um Zugang zum Thymus zu erhalten, der sich über dem Herzen befindet. Identifizieren Sie dann den Thymus, der aus zwei weißen Lappen besteht. Mit Zangen, lösen Sie den Thymus vorsichtig und legen Sie ihn auf eine Petrischale mit fünf MilliliterHBS2% FCS.
Um die Immunzellen zu isolieren, legen Sie den Thymus zunächst auf ein 40 Mikrometer Zellsieb in der Petrischale. Zerkleinern Sie das Gewebe mit einem Kolben, um es in die Schale zu dissoziieren. Danach spülen Sie den Kolben und das Sieb mit HBSS 2% FCS, um alle haftenden Zellen wiederherzustellen. Dann pipette die dissoziierten Thymuszellen und Flüssigkeit aus der Petrischale in ein 15 Milliliter Zentrifugenrohr. Waschen Sie die Petrischale mit fünf Millilitern HBSS 2% FCS und übertragen Sie diese Waschlösung auch auf das 15 Milliliter Zentrifugenrohr.
Als nächstes zentrifugieren Sie das Rohr bei 370 mal g für sieben Minuten bei 20 Grad Celsius. Entsorgen Sie den Überstand und setzen Sie das Pellet in zwei MilliliterACK-Lysingpuffer wieder auf, um die Erythrozyten zu lyse. Zwei Minuten bei Raumtemperatur auf der Bankplatte inkubieren. Dann bringen Sie das Volumen auf 14 Milliliter mit HBSS 2% FCS. Zentrifugieren Sie das Rohr bei 370 mal g für sieben Minuten bei 20 Grad Celsius. Entsorgen Sie dann den Überstand und setzen Sie die Zellen in fünf Millilitern HBSS 2% FCS wieder aus.
Schätzen Sie die Zellkonzentration anhand eines Malassez-Dias, wie im Protokoll zur FACS-Isolierung von B-Lymphozyten gezeigt, und passen Sie die Zellkonzentration auf 10 auf die siebten Zellen pro Milliliter mit HBSS 2% FCS an.
Übertragen Sie 500 Mikroliter Zelllösung in zwei FACS-Röhren. Beschriften Sie eine Röhre nicht angereicherte T-Zellen und die anderen röhrenangereicherten T-Zellen, die durch magnetische Beschriftung getrennt werden.
Zentrifugieren Sie das angereicherte T-Zellen-Rohr bei 370 mal g für drei Minuten bei 20 Grad Celsius. Entsorgen Sie den Überstand und setzen Sie das Pellet in 250 Mikroliter Biotin gekoppelten Anti-CD3-Antikörper verdünnt ein s.in 400 in HBSS 2% FCS. Inkubieren Sie die Zellen für 20 Minuten auf Eis und im Dunkeln. Fügen Sie drei Milliliter HBSS 2% FCS in die Rohre und zentrifugieren Sie sie wieder bei 370 mal g für drei Minuten bei 20 Grad Celsius. Entsorgen Sie den Überstand und setzen Sie das Pellet in 250 MikroliterStreptavidin-gekoppelten Perlen in HBSS 2% FCS verdünnt. Die Mischung aus Zellen und Perlen 20 Minuten lang auf Eis bebrüten. Als nächstes fügen Sie drei Milliliter HBSS 2% FCS in das Rohr, Pipette nach oben und unten zu mischen, und Zentrifuge wieder bei 370 mal g für drei Minuten bei 20 Grad Celsius. Setzen Sie das Pellet in zwei Milliliter HBSS 2% FCS aus.
Legen Sie die Säule auf den Magneten und fügen Sie drei Milliliter HBSS 2% FCS hinzu, um das System zu befeuchten. Dann pipette die gefärbten Zellen in die Spalte. Nachdem die Zellsuspension durch die Säule geht, waschen Sie die Säule dreimal mit drei Millilitern HBSS 2% FCS. Entfernen Sie als Nächstes die Säule vom Magneten und legen Sie sie in ein 15-Milliliter-Rohr. Um die Zielzellen zu löschen, fügen Sie der Spalte fünf Milliliter HBSS 2% FCS hinzu und spülen Sie die Spalte mit einem Kolben. Wiederholen Sie diesen Schritt mit weiteren fünf Millilitern HBSS 2% FCS.
Um die Wirksamkeit der Zielzellisolierung zu bewerten, übertragen Sie zunächst 500 Mikroliter eluierte Zellsuspension in ein FACS-Rohr und beschriften Sie sie angereicherte T-Zellen. Dann zentrifugieren Sie sowohl die angereicherten als auch die nicht angereicherten Rohre bei 370 mal g für sieben Minuten bei 20 Grad Celsius. Entsorgen Sie den Überstand, und fügen Sie dann 100 Mikroliter fluoreszierender Antikörper, der in 200 in HBSS 2% FCS verdünnt wird, in beide Röhren. Inkubieren Sie die Zellen für 20 Minuten auf Eis und im Dunkeln. Als nächstes fügen Sie drei Milliliter HBSS 2% FCS in die Rohre und zentrifugieren Sie sie bei 370 mal g für drei Minuten bei 20 Grad Celsius. Entsorgen Sie den Überstand, und setzen Sie die Pellets in 250 Mikroliter HBSS 2% FCS wieder aus. Bewerten Sie nun die CD3-positive Zellanreicherungsrate mithilfe der Durchflusszytometrie, wie im FACS-Protokoll gezeigt.
Nun werden wir die Häufigkeit von CD3-positiven Lymphozyten unter allen Thymosyten bestimmen, die vom Mausthymus isoliert wurden. Um zu starten, doppelklicken Sie auf das FlowJo-Symbol und ziehen Sie die Dateien für jede Röhre im gesamten Beispielfenster. Doppelklicken Sie dann auf die angereicherte T-Zellen-Datei, um die zellen, die von dieser Probe aufgezeichnet wurden, auf einem Punktdiagramm anzuzeigen, das Vorwärtsstreuung, FSCA auf der x-Achse und Seitenstreuung, SSCA, auf der y-Achse anzeigt.
Klicken Sie auf Polygon, um die Lymphozytenpopulationen zu umkreisen. Doppelklicken Sie anschließend auf die eingekreiste Grundgesamtheit, um ein neues Fenster zu erstellen. Wählen Sie FSC-W auf der y-Achse und FSC-A auf der x-Achse und kreisen Sie die FSA-W-Negativzellen. Benennen Sie im Identifikationsfenster für die Untergrundgesamtheit die Zellenpopulation Als Einzelzellen. Klicken Sie als Nächstes im Identifikationsfenster der Untergrundbevölkerung auf OK und doppelklicken Sie dann auf die eingekreiste Grundgesamtheit, um ein neues Fenster zu erstellen. Wählen Sie CD3 auf der y-Achse aus, und kreisen Sie die CD3-positiven Zellen. Benennen Sie im Identifikationsfenster für die Untergrundgesamtheit Die T-Zellen Der Zellenderpopulation. Wiederholen Sie dies mit der nicht angereicherten T-Zellen-Datei. Um die Zellenpopulation zu visualisieren, klicken Sie auf Layout-Editor, und ziehen Sie die T-Zellen-Population aus angereicherten T-Zellen und nicht angereicherten T-Zellen-Dateien auf die Registerkarte.
Punktdiagramme, die CD3-positive Lymphozyten darstellen, werden angezeigt. CD3-positive Zellen sollten nur in der Population von Interesse in der CD3-positiven angereicherten Röhre erscheinen. Um die Anreicherung von CD3-positiven Lymphozyten in den sortierten Zellen auszuwerten, klicken Sie auf den Tabelleneditor, und ziehen Sie dann die T-Zellen-Population aus angereicherten T-Zellen und nicht angereicherten T-Zellen-Dateien in die Tabelle. Wählen Sie im Statistikmenü Frequenz der Lymphozytenzellen aus, um den Prozentsatz der CD3-positiven Zellen in allen Lymphozyten zu überprüfen. Klicken Sie dann auf Tabelle erstellen. Parameterwerte werden in einer neuen Tabelle angezeigt. Bei den angereicherten T-Zellen sollte die Frequenz von CD3-positiven Zellen bei etwa 80% oder höher liegen.
Subscription Required. Please recommend JoVE to your librarian.
Results
In diesem Protokoll wurden CD3-positive Zellen mit Hilfe der magnetischen Zellsortierung aus thymischen Leukozyten angereichert (Abbildung 1). Vor der magnetischen Zellanreicherung machten CD3-positive Zellen 53,6 % der gesamten thymischen Zellen aus (Abbildung 2, obere Panels). Nach der anreicherung der magnetischen Zellen stieg der Anteil der CD3-positiven Zellen auf 95 % (Abbildung 2, untere Panels). Somit ist MACS eine einfache, schnelle und effiziente Zellanreicherungstechnik, um gewünschte Zellpopulationen aus einem Zellsuspensionsgemisch zu bereichern.

Abbildung 2: Gating-Strategie und Reinheitstestsortierung. Zellen werden zuerst basierend auf ihrer Morphologie (links: FSC-A, SSC-A) und dann Zellen gegen CD3 (rechts: CD3, SSC-A) geplottet. Die obere Platte stellt die Thymuszellsuspension vor der Zellanreicherung dar. Die untere Platte stellt die Thymuszellsuspension nach der magnetischen Zellsortierung dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Die Magnetische Trenntechnologie ist eine gängige Methode, um eine Zielzellpopulation einfach und schnell zu sortieren. Mit T-Zellen spezifische Antikörper und magnetische Perlen haben wir T-Zellen Frequenz in unserer Probe angereichert. Die Reinheitsrate am Ende des Experiments hängt vom Prozentsatz der Zielzellen in der anfänglichen Zellsuspension ab. Zellen, die nach der magnetischen Zellsortierung gewonnen werden, können für verschiedene Zwecke wie zellübertragung oder Zellzyklusanalyse verwendet werden. Eine andere Sortiermethode, die die Durchflusszytometrie verwendet, kann verwendet werden, um Zellen anzureichern. Diese Technik liefert eine sehr hohe Reinheitsrate nach der Zellsortierung, erfordert jedoch mehr Schritte und nimmt mehr Zeit in Anspruch.
Subscription Required. Please recommend JoVE to your librarian.
References
- Owen, C. S. and Sykes, N. L. Magnetic labeling and cell sorting. Journal of Immunological Methods. 73 (1), 41-48 (1984).
- Miltenyi, S., Müller, W., Weichel, W. and Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Plouffe, B. D., Murthy, S. K. and Lewis, L. H. Fundamentals and application of magnetic particles in cell isolation and enrichment: a review. Reports on Progress in Physics. 78 (1), (2014).




