Overview
Fuente: Tonya J. Webb1
1 Departamento de Microbiología e Inmunología, Facultad de Medicina de la Universidad de Maryland y el Centro Integral del Cáncer Marlene y Stewart Greenebaum, Baltimore, Maryland 21201
ELISPOT es un ensayo estandarizado y reproducible que se utiliza para detectar respuestas inmunitarias celulares. El ensayo utiliza un método basado en el ensayo inmunoabsorbente ligado a enzimas (ELISA) para detectar respuestas inmunitarias de una sola célula que pueden ser visualizadas por manchas, de ahí el nombre ELISPOT. ELISPOT fue descrito por primera vez en 1983, por Czerkinsky, como un método para enumerar el número de hibridaomas de células B que producen inmunoglobulinas específicas de antígenos (1). El mismo grupo desarrolló el ensayo para medir la frecuencia de los linfocitos T productores de citoquinas. Ahora ELISPOT se ha convertido en un estándar de oro para medir la inmunidad de células T específicas de antígenos en ensayos clínicos y candidatos a vacunas. Por ejemplo, después de la vacunación o durante una infección, las células plasmáticas y las células B de memoria secretan anticuerpos que proporcionan protección. Por lo general, estas respuestas de células B se evalúan midiendo los valoradores séricos de anticuerpos específicos de antígenos. Sin embargo, este tipo de análisis, normalmente medido por ELISA, puede no incluir células de memoria B, que pueden estar presentes incluso en ausencia de niveles de anticuerpos séricos detectables. Además, se ha establecido que las células B de memoria circulante son importantes para la respuesta rápida y protectora de anticuerpos observada después de la reexposición de patógenos, por lo que es fundamental poder detectar estas células. Por lo tanto, para evaluar claramente las respuestas de células B de memoria específica del antígeno, se deben utilizar TANTO ELISA como ELISPOT (2).
El ensayo ELISPOT utiliza una placa que contiene pozos revestidos de membrana que están recubiertos con anticuerpos con el fin de capturar proteínas secretas de interés. Luego, la placa se carga con células y estímulos para inducir la producción de proteínas. Las proteínas secretadas son capturadas por los anticuerpos recubiertos en la superficie. Después del tiempo de incubación adecuado, las células se eliminan y la molécula secretada se detecta mediante el uso de un anticuerpo biotinilado que es específico para un epítopo diferente, en comparación con el anticuerpo de captura. A continuación, se añade la estreptavidina peroxidasa, seguida de la adición de un sustrato que permite la detección de las manchas (Figura 1). La fuerza de este ensayo es que permite cuantificar el número de células que producen la proteína de interés. Es importante destacar que se puede evaluar si hay cambios en el número total de células que producen una proteína específica o si las células individuales dentro de una población están produciendo más proteína. Además, puede proporcionar información sobre la cinética y se puede utilizar para evaluar la activación inmune general (estimulación de mitogenos) en relación con las respuestas específicas del antígeno (simulación de antígeno). El ensayo ELISPOT permitirá la detección de una célula activada entre 300.000 células después de la activación mitogénica o específica del antígeno.
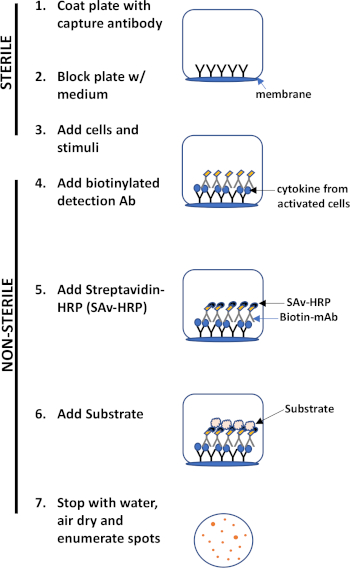
Figura 1: Descripción general del protocolo ELISPOT.
Las principales ventajas de este ensayo son su- a. Simplicidad - el protocolo es relativamente simple y directo. No requiere experiencia técnica, b. Sensibilidad- permite la detección de células inmunitarias a nivel de células únicas y requiere muy pocas células en comparación con otros métodos como la citometría de flujo, c. Funcionalidad- proporciona datos cuantitativos con respecto al inmune Función.
Este ejercicio de laboratorio demuestra el protocolo ELISPOT para la detección de esplenocitos secretos de IFN-o, pero como se mencionó anteriormente este ensayo también se puede utilizar para evaluar la secreción de anticuerpos por células B (3).
Procedure
1. Configuración
Búferes y reactivos
- Salina estéril con fosfato (PBS) sin calcio o magnesio
- Tampón de recubrimiento: PBS estéril o tampón de carbonato
- Ensayo diluyente- 10% suero bovino fetal (FBS) en PBS
- Cultivo celular medio- RPMI 1640 con 10% FBS, penicilina/estreptomicina, y L-glutamina
- Tampón de lavado- PBS que contiene 0.05% Tween20
- Agua destilada doble (ddH2O)
- Sustrato de detección- 100 mg AEC (3-amino-9-etil-carbazol) en 10 mL DMF (N,N, Dimetilformamida).
Equipo
- Capucha de flujo laminar
- Incubadora humedecida (establecida a 37oC, 5% CO2)
- Lector ELISPOT automatizado o microscopio de disección
Materiales
- Placas ELISPOT
- Reservorios estériles y no estériles
- Pipettors y puntas
- Pipetas serológicas estériles
- Tubos de polipropileno cónicos estériles
- Dos botellas de compresión para el lavado de placas
Reactivos específicos de ensayo
- Células- células primarias o líneas celulares (aquí, se utilizaron esplenocitos de ratones C57BL/6)
- Estimulantes- mitógeno o antígeno (aquí, se utilizaron phorbol 12-miristate 13-acetate (PMA, 50 ng/mL) e ionomicina (1 m))
- Anticuerpo primario- anticuerpo anticitoquina biotinilado (diluido a 2 g/ml en el diluyente del ensayo)
- Anticuerpo secundario- estreptavidina-caballo de peroxidasa (SAv-HRP)
2. Procedimiento
Capa
- Manteniendo las condiciones estériles y dentro de una campana de flujo laminar, diluya el anticuerpo purificado de captura anticitoquina a una concentración final de 0,5-4,0 g/ml en tampón de recubrimiento estéril. (Nota: para IFN- e IL-6 utilizan 5 g/ml).
- Transfiera la solución de anticuerpos de captura, de 100 ml/bien, a la placa ELISPOT.
- Cubra la placa con una cubierta de placa y séllela para evitar la evaporación.
- Incubar la placa durante la noche a 4oC.
Bloqueo
- Al día siguiente, descubra la placa ELISPOT en la campana de flujo laminar. Invierta rápidamente la placa en toallitas estériles para eliminar la solución de anticuerpos de captura de cada pocal.
- A continuación, agregue 200 s de medio de cultivo celular a cada poca. Este paso bloqueará el enlace no específico durante el ensayo.
- Sustituya la cubierta de la placa e incubar la placa durante 2 horas a 37oC.
Placado y Activación de Células
- Mientras la placa se está incubando, prepare una solución de 2x mitogenos que contenga 50 ng/ml de PMA y 1 m de ionomicina en el medio de cultivo celular.
- Luego, prepare suspensiones celulares objetivo a una concentración de stock de 2 x 106 células/ml.
- Una vez completada la incubación, retire el medio de cultivo celular de cada pocal invirtiendo rápidamente la placa en toallitas estériles dentro de la campana de flujo laminar.
- A continuación, genere una dilución en serie 2X de la solución de suspensión de celda sin material. Para ello, primero agregue 200 l de la solución de material de suspensión celular preparada en los pozos de la fila superior de la placa ELISPOT.
- A continuación, agregue 100 l de medio de cultivo de celda sin formato a las siguientes cinco filas de la placa debajo de las filas que contienen la solución de culata.
- Después de eso, realice una dilución en serie 2X pipeteando 100 l de la suspensión celular desde la fila superior en la fila directamente debajo. Asegurar una mezcla adecuada pipeteando suavemente esta solución hacia arriba y hacia abajo para asegurar una distribución uniforme de las células.
- Repita este proceso para las cuatro filas restantes.
- Deje la sexta fila con el medio de cultivo solamente. Servirá como control experimental.
- A continuación, añadir 100 l de la solución de mitogeno preparada a los pozos experimentales de las primeras cinco filas de la placa. En los pozos de control y la sexta fila, agregue 100 l de los medios de cultivo celular sin mitón.
- Sustituya la cubierta de la placa y la placa de incubación a 37oC, 5% CO2 en una incubadora durante 20-48 horas. (Nota: 20-24 horas es típicamente suficiente para detectar IL-2 y TNF- , mientras que 48 horas es óptima para IL-4 e IFN-).
Detección
Anticuerpo primario
- Preparar el anticuerpo anticitoquina biotinilado a una concentración de 2 g/ml en el diluyente del ensayo.
- Prepare 20-25 ml de tampón de lavado en este momento mezclando 0.05% Tween-20 en PBS.
- Una vez completada la incubación, destapa ralentí la placa y invirte rápidamente sobre un fregadero para eliminar todo el líquido de los pozos. (Nota: Después de este punto, la placa ya no tiene que mantenerse estéril).
- A continuación, lave la placa añadiendo un tampón de lavado de 200 l a cada poca. Expulse este líquido invirtiendo y deslizando rápidamente la placa sobre un fregadero. Repita este proceso para un total de cinco lavados.
- A continuación, añadir 100 l de la solución de anticuerpos de detección de anticitoquinas biotiladas diluidas a cada pocillo. Incubar a temperatura ambiente durante 2 horas a temperatura ambiente o durante la noche a 4oC.
Anticuerpo secundario
- Una vez completada la incubación, expulse el anticuerpo de detección invirtiendo y deslizando la placa sobre el fregadero.
- Como antes, lave la placa 5 veces con tampón de lavado de 200 l, expulsando el líquido entre cada lavado.
- A continuación, añadir 100 l de solución diluida de estreptavidina-caballo de peroxidasa a cada pocal (diluido a su concentración óptima predeterminada en diluyente de ensayo).
- Sustituya la cubierta de la placa e incubar a temperatura ambiente durante 1,5-2 horas a 37oC.
Sustrato
- Después de la incubación, no más de 15 minutos antes de su uso, primero active la solución de sustrato AEC de acuerdo con las instrucciones del fabricante.
- A continuación, deseche el contenido de los pozos y lave el plato cinco veces con tampón de lavado, como antes.
- A continuación, agregue inmediatamente 100 ml de solución de sustrato AEC preparada en cada poca.
- Incubar la placa a temperatura ambiente durante 10-20 minutos mientras supervisa el desarrollo del punto.
- Detenga la reacción encerrando la placa con agua y moviendo la placa sobre el fregadero.
- Borre la placa sobre toallas de papel y deje que la placa se seque al aire durante la noche o hasta que esté completamente seca. Extracción de la bandeja de plástico debajo de la placa facilitará el secado.
3. Adquisición y Análisis de Datos
- Después del secado, las manchas están listas para ser contadas con un lector de placas automatizado. Aquí, se utiliza el lector de inmunopuntoctl, pero este protocolo se puede adaptar para cualquier lector.
- Primero encienda el instrumento, luego el ordenador. A continuación, abra el programa CTL y haga clic en "scan count."
- Presione "expulsar" para que la bandeja se extienda desde la máquina. A continuación, retire el adaptador de plástico y alinee la fila "A" en la placa Y el adaptador ELISPOT.
- Elija un nombre de archivo y una ubicación para el archivo que desea guardar y cargue la placa en la bandeja.
- A continuación, haga clic en "cargar" en el software y cierre la puerta en el lado de la máquina.
- Pulse "start- after counting." Asegúrese de que el archivo está guardado y, a continuación, abra el software de control de calidad "QC" para analizar los datos y contar el número de puntos.
Notas:
- El número mínimo de celdas debe determinarse en experimentos preliminares. El número óptimo de puntos es de 50 euros/bueno. Si se cargan demasiadas celdas, será difícil detectar puntos distintos. Además, las células se superponen y no pueden formar una monocapa en la membrana, por lo que el nivel de detección puede reducirse.
- Al optimizar el experimento, tenga en cuenta el nivel de expresión esperado de la proteína objetivo. Cuanto menor sea la expresión, mayor será el número de celdas requeridas por pozo.
- A diferencia de ELISA, es mejor lavar a mano la placa en lugar de usar una lavadora de placas. Las placas ELISPOT son más delicadas y se debe evitar punción de la membrana PVDF.
- Uno debe limitar el movimiento de la placa durante el período de incubación, ya que puede hacer que las manchas se difuminen.
- Las placas deben almacenarse en la oscuridad, ya que la exposición a la luz directa hace que las manchas se desvanezcan.
El ensayo Inmunospot ligado a enzimas, o ELISPOT, es un método para analizar la respuesta inmunitaria a un patógeno o daño celular. Permite cuantificar la activación de diferentes células inmunitarias mediante la detección de proteínas específicas que secretan. Por ejemplo, ELISPOT se utiliza comúnmente para medir las respuestas de las células T al exponerse a un antígeno extraño mediante la detección de citoquinas secretas.
Para un ensayo ELISPOT basado en citoquinas, el proceso comienza con el recubrimiento de una microplaca ELISPOT con un anticuerpo de captura, que es específico de la citoquina objetivo. Después del recubrimiento de anticuerpos, las células T se añaden a los pozos y son estimuladas por un agente externo, como el anticuerpo anti-CD3, por ejemplo. Las células entonces secretan la citoquina objetivo, que inmediatamente es inmovilizada por el anticuerpo de captura. Dado que la proteína se captura instantáneamente después de la secreción de células vivas, sin dilución o degradación, este ensayo tiene una alta precisión. Después de inmovilizar la citoquina objetivo, se añade un anticuerpo de detección, que también se une a la citoquina capturada.
La técnica ELISPOT también se puede utilizar para cuantificar las células B de la memoria después de una infección o vacunación mediante el análisis de su producción de anticuerpos específicos. En un ELISPOT basado en anticuerpos, se utiliza un antígeno específico en lugar de un anticuerpo para el paso de captura, donde el antígeno se unirá a la placa, o en el paso de detección, donde el antígeno detecta el anticuerpo objetivo después de la captura. En todas las variaciones del proceso, para las células T o células B, el anticuerpo de detección o antígeno es biotintilado, lo que le permite unirse a una enzima de detección conjugada con estreptavidina, como la peroxidasa de rábano picante. Luego, tras la adición del sustrato de la peroxidasa, se produce un precipitado oscuro e insoluble. Este precipitado marca la ubicación de la proteína capturada, y cada célula secretora da como resultado un punto visible, que se puede cuantificar utilizando un lector ELISPOT o un microscopio. El tamaño de las manchas es una estimación relativa de la cantidad de proteína secretada de cada célula. Este ensayo puede detectar respuestas inmunitarias de células individuales, incluso en subpoblaciones relativamente pequeñas de células secretoras, por lo que es útil para estudiar las respuestas inmunitarias a nivel celular.
En este video, aprenderá cómo realizar un ensayo ELISPOT y luego cuantificar los lugares que representan las células secretoras.
A lo largo del experimento, asegúrese de que las condiciones estériles trabajen en una capucha de flujo laminar y usen guantes.
Todos los cálculos de este protocolo se basan en el volumen necesario para una placa de 96 pocillos.
En primer lugar, diluir el anticuerpo de captura anticitoquina. Para ello, transfiera 10 mililitros de amortiguador a un tubo cónico estéril de 15 mililitros. A continuación, utilice una pipeta para añadir 10 microlitros de un miligramo por mililitro de anticuerpo monoclonal al tampón para crear una solución con una concentración final de un microgramo por mililitro. A continuación, vierta la solución de anticuerpos de captura en un depósito estéril y, utilizando una pipeta multicanal, distribuya 100 microlitros en cada pocal de una placa ELISPOT de 96 pocillos.
Cubra la placa con una cubierta de placa, séllela para evitar la evaporación e incubar durante la noche a cuatro grados centígrados. Al día siguiente, descubra la placa ELISPOT en la campana de flujo laminar. Invierta rápidamente la placa en toallitas estériles para eliminar la solución de anticuerpos de captura de cada pocal. A continuación, utilice una pipeta multicanal para agregar 200 microlitros de medio de cultivo celular a cada pocal. Este paso bloqueará el enlace no específico durante el ensayo. Reemplace la cubierta de la placa e incubar en una incubadora de 37 grados Celsius durante dos horas.
Mientras la placa está incubando, prepare una solución de 2X mitogeno agregando un microlitro de PMA y 20 microlitros de ionomicina a 10 mililitros de medio de cultivo celular para lograr una concentración final de 15 nanogramos por mililitro de PMA y una yonomicina micromolar.
Las suspensiones celulares de los splenocitos de ratón también deben prepararse en este momento en una campana estéril. Usando un microscopio y un hemocitómetro, mida la concentración de células y ajuste el volumen total hasta alcanzar una concentración de existencias de dos millones de células por mililitro.
Una vez completada la incubación, invierta rápidamente la placa en toallitas estériles para eliminar el medio de cultivo celular de cada pocal. A continuación, agregue 200 microlitros de la solución de suspensión celular preparada a los pozos de la fila superior de la placa ELISPOT. Configure el experimento en triplicado, de modo que cada tipo de celda probada se cene en un conjunto de tres columnas agrupadas. Debajo de esto, agregue 100 microlitros de medio de cultivo de células simples a las siguientes cinco filas de la placa, debajo de las filas que contienen la solución de stock celular.
A continuación, realice una dilución en serie pipeteando 100 microlitros de la suspensión celular desde la fila superior en la fila directamente debajo, pipeteando suavemente la solución hacia arriba y hacia abajo para distribuir uniformemente las células. Repita este proceso para las filas restantes, moviendo 100 microlitros de la fila anterior a la fila de abajo en cada paso, continuando hasta que la quinta fila se haya diluido en serie. Deje la sexta fila con solo medio de cultivo celular, para servir como un control. Para estimular las células en los pozos experimentales de la placa, añadir 100 microlitros de la solución de mitón preparado a las suspensiones celulares en cada pozo de las filas uno a cinco. Asegúrese de dejar la sexta fila, que servirá como el control, sin estimular. Reemplace la tapa e incubar la placa a 37 grados Centígrados y 5% de CO2 durante 24 a 48 horas.
Preparar el anticuerpo anticitoquina biotinilado diluido. Primero, preparar 50 mililitros de diluyente de ensayo añadiendo 5 mililitros de 10% de suero bovino fetal a 45 mililitros de PBS. A continuación, diluir el anticuerpo de detección a una concentración de 2 microgramos por mililitro en diluyente de ensayo. Además, prepare de 20 a 25 mililitros de tampón de lavado en este momento, mezclando .05% Tween-20 y PBS.
Una vez completada la incubación, destapa rallar la placa e invertirla rápidamente para eliminar todo el líquido de los pocillos. Lave la placa añadiendo alrededor de 200 microlitros de tampón de lavado a cada poca. Expulse este líquido invirtiendo y deslizando rápidamente la placa sobre un fregadero. Repita este proceso cuatro veces más para un total de cinco lavados. A continuación, añadir 100 microlitros de la solución de anticuerpos de detección diluida a cada pocil, reemplazar la tapa e incubar a temperatura ambiente durante dos horas. Después de la incubación, expulsar la solución de anticuerpos de detección de los pozos de la placa invirtiendo y moviendo la placa sobre el fregadero.
Como antes, lave el plato cinco veces con tampón de lavado, expulsando el líquido entre cada lavado. Después del lavado final, preparar la solución de peroxidasa de estreptavidina-rábano diluyéndola de acuerdo con las instrucciones del fabricante. A continuación, con los pozos de la placa vacíos, añadir 100 microlitros de estreptavidina diluida- solución de peroxidasa de rábano picante a cada pocal. Vuelva a colocar la tapa en la placa e incubar a temperatura ambiente durante dos horas.
Después de la incubación, no más de 15 minutos antes de su uso, active la solución de sustrato AEC prefabricada. Deseche el contenido de los pozos y lave el plato cinco veces con tampón de lavado, como antes. A continuación, agregue inmediatamente 100 microlitros de solución de sustrato AEC preparada en cada poca. Deje que la placa a temperatura ambiente se desarrolle durante aproximadamente 10 a 20 minutos, mientras supervisa el desarrollo del punto. Estas manchas aparecerán como pequeñas círculos oscurecidas en la superficie de los pozos. A continuación, detenga la reacción encerrando la placa con agua y golpeándola sobre el fregadero. Soplar la placa sobre toallas de papel y dejar secar al aire durante la noche o hasta que esté completamente seca. Extracción de la bandeja de plástico debajo de la placa facilitará el secado. Después del secado, las manchas están listas para ser contadas con un lector de placas automatizado.
Aquí, se utiliza el lector CTL ImmunoSpot, pero este protocolo se puede adaptar para cualquier lector. A continuación, abra el programa CTL y haga clic en Scan Count. Empuje la expulsión para que la bandeja se extienda desde la máquina. A continuación, retire el adaptador de plástico y alinee la fila A en la placa ELISPOT y el adaptador. Elija un nombre de archivo y una ubicación para el archivo que se va a guardar y cargue la placa y el adaptador en la bandeja. Haga clic en Cargar en el software y cierre la puerta en el lateral de la máquina. A continuación, pulse Iniciar después de contar. Asegúrese de que el archivo está guardado y, a continuación, abra el software Control de calidad QC para analizar los datos y contar el número de puntos. Exporte estos datos como un archivo de Excel. Una vez completado el análisis, haga clic en Expulsar para recuperar la placa.
En este experimento, las células de los ratones de tipo salvaje y tumoral fueron chapadas y analizadas para la gamma IFN. Observe que el número de manchas disminuye con la disminución de la concentración celular. Normalmente, los datos ELISPOT se presentan como el número de recuentos de puntos por número de celdas chapadas. En este ejemplo, el número de puntos se mostraron en un gráfico de barras, con cada concentración celular respectiva listada en el eje X. Observe que el número de puntos indica el número de celdas activadas por número total de celdas en un población determinado.
Subscription Required. Please recommend JoVE to your librarian.
Results
En este ensayo ELISPOT, se analizaron leucocitos esplénicos de ratones de tipo salvaje y tumores para ifN-o. La figura 2 A muestra la imagen visual del resultado del ensayo. Los números en el color verde indican el número de puntos por pozo (TNTC indica "demasiado numerosos para contar"). Observe que el número de manchas disminuye con la disminución de la concentración celular.

Figura 2A: Disminución de las respuestas inmunitarias en ratones portadores de tumores. Haga clic aquí para ver una versión más grande de esta figura.
Normalmente, los datos ELISPOT se presentan como el número de recuentos de puntos por número de celdas chapadas. En la Figura 2 B el número de puntos se muestra en un gráfico de barras, con cada concentración celular respectiva listada en el eje X. Para fines gráficos, se utilizaron 150 para indicar el número máximo de puntos. El número de leucocitos plánteros de IFN-o que producen leucocitos murinos en animales portadores de tumores es menor que los de tipo salvaje.

Figura 2B: Disminución de las respuestas inmunitarias en ratones portadores de tumores. Los esplenocitos se cosecharon de los ratones de control C57BL/6 (tipo salvaje) y tumores y se estimularon con PMA/ionomicina durante 48 horas. Los ensayos elISPOT se utilizaron para cuantificar el número de leucocitos esplénicos productores de IFN. (A) Representación gráfica visual y (B) de los datos. TNTC indica demasiado numerosos para contar. Para fines gráficos, se utilizaron 150 para indicar el número máximo de puntos. Los números verdes indican el número de puntos contados por pozo. Los números rojos indican los pozos de referencia que se utilizaron para determinar qué manchas eran células y qué manchas eran escombros, artefactos o efectos de borde y deben excluirse del análisis.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
El ensayo ELISPOT permite evaluar la activación de las células inmunitarias determinando el número de células que segregan un analito específico. El tamaño y la intensidad de las manchas proporciona información sobre la cantidad de analito que produce cada célula. El protocolo descrito anteriormente detallaba la detección de una sola citoquina. Sin embargo, los acontecimientos recientes han mejorado la utilidad de este ensayo. Actualmente, se pueden utilizar colorantes de detección fluorescentes para detectar múltiples analitos dentro de un pozo. Esto permite la detección de diferentes subpoblaciones de células que segregan uno o ambos analitos.
Subscription Required. Please recommend JoVE to your librarian.
References
- Czerkinsky, C. C., Nilsson, L. A., Nygren, H., Ouchterlony, O., & Tarkowski, A. A solid-phase enzyme-linked immunospot (ELISPOT) assay for enumeration of specific antibody-secreting cells. Journal of Immunological Methods, 65 (1), 109-121(1983).
- Wahid, R., Simon, J. K., Picking, W. L., Kotloff, K. L., Levine, M. M., & Sztein, M. B. Shigella antigen-specific B memory cells are associated with decreased disease severity in subjects challenged with wild-type Shigella flexneri 2a. Clinical Immunology, 148 (1), 35-43 (2013).
- Roberts, T. J., Lin, Y., Spence, P. M., Van Kaer, L., & Brutkiewicz, R. R. CD1d1-dependent control of the magnitude of an acute antiviral immune response. The Journal of Immunology, 172, 3454-3461 (2004).




