Overview
资料来源:托尼娅·韦伯1
1马里兰大学医学院微生物学和免疫学系,马里兰州巴尔的摩的马琳和斯图尔特·格林鲍姆综合癌症中心 21201
ELISPOT 是一种标准化的、可重复的检测,用于检测细胞免疫反应。该测定利用一种基于酶链接的免疫吸附测定(ELISA)方法检测单细胞免疫反应,这些反应可以通过斑点可视化,因此命名为ELISPOT。1983年,Czerkinsky首次将ELISPOT描述为一种列举产生抗原特异性免疫球蛋白(1)的B细胞杂交瘤数量的方法。同一组进一步开发了测定,以测量细胞因子产生T淋巴细胞的频率。现在,ELISPOT已成为在临床试验和疫苗候选中测量抗原特异性T细胞免疫的黄金标准。例如,在接种疫苗后或感染期间,血浆细胞和记忆B细胞分泌抗体,提供保护。通常,通过测量抗原特异性抗体的血清位子来评估这些B细胞反应。然而,这种类型的分析,通常由ELISA测量,可能不包括记忆B细胞,即使在没有可检测的血清抗体水平的情况下,也可能存在记忆B细胞。此外,循环记忆B细胞对于病原体重新暴露后观察到的快速保护性抗体反应非常重要,因此能够检测这些细胞至关重要。因此,为了清楚地评估抗原特异性记忆B细胞反应,应同时使用ELISA和ELISPOT(2)。
ELISPOT 测定使用含有膜衬里孔的板,这些孔被涂有抗体,以捕获感兴趣的分泌蛋白质。然后,板加载细胞和刺激,以诱导蛋白质生产。分泌的蛋白质被表面涂覆的抗体捕获。在适当的孵育时间后,细胞被移除,并且使用生物缩化抗体检测分泌的分子,该抗体是特定为不同表位,与捕获抗体相比。接下来,加入链球菌蛋白过氧化物酶,然后添加基板,允许检测斑点(图1)。这种测定的用量是,它允许定量出产生感兴趣的蛋白质的细胞数量。重要的是,人们可以评估产生特定蛋白质的细胞总数是否有变化,或者种群中的单个细胞是否产生更多的蛋白质。此外,它可以提供有关动力学的信息,并可用于评估与抗原特异性反应(抗原模拟)相关的整体免疫活化(米托根刺激)。ELISPOT测定将允许在线生成或抗原特异性激活后在300,000个细胞中检测一个活化细胞。
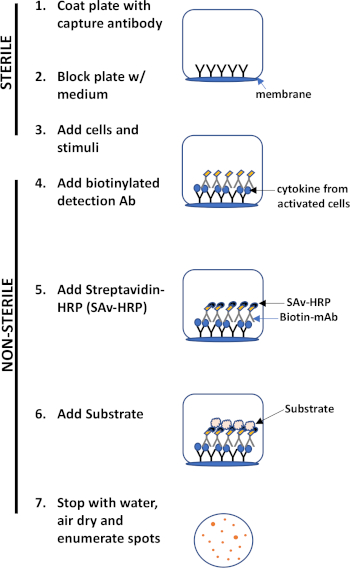
图 1:ELISPOT 协议概述。
这种测定的主要优点是它简单,协议相对简单明了。它不需要技术专长,b. 敏感性 - 它允许在单个细胞水平上检测免疫细胞,并且与其他方法(如流式细胞测量、c. 功能)相比,它只需要很少的细胞,它提供有关免疫的定量数据功能。
本实验演示了用于检测IFN-分泌-血细胞的ELISPOT协议,但如上所述,此测定也可用于评估B细胞(3)的抗体分泌。
Procedure
1. 设置
缓冲液和试剂
- 不含钙或镁的无菌磷酸盐缓冲盐 (PBS)
- 涂层缓冲液 - 无菌 PBS 或碳酸盐缓冲器
- PBS 中测定稀释 - 10% 胎儿牛血清 (FBS)
- 细胞培养介质-RPMI 1640,带10%FBS、青霉素/链霉素和L-谷氨酰胺
- 洗涤缓冲液 - 含有 0.05% Tween20 的 PBS
- 双蒸馏水 (ddH2O)
- 检测基质- 100mg AEC(3-氨基-9-乙基-卡巴佐尔),在10mL DMF(N,N,二甲基甲酰胺)。
设备
- 拉米纳尔流量罩
- 加湿培养箱(设置在37°C,5%CO2)
- 自动 ELISPOT 阅读器或解剖显微镜
材料
- 埃利SPOT板
- 无菌和非无菌储液罐
- 移管器和提示
- 无菌血清学移液器
- 无菌、锥形聚丙烯管
- 两个挤压瓶,用于洗板
测定特异性试剂
- 细胞- 原细胞或细胞系(这里,使用C57BL/6小鼠的血细胞)
- 兴奋剂 - 线粒素或抗原(此处,使用磷脂 12-米精酸盐 13-醋酸酯 (PMA, 50 ng/mL) 和碘霉素 (1 μM)
- 原发抗体-生物氨酸抗细胞因子检测抗体(在测定稀释剂中稀释至2微克/mL)
- 二次抗体-链球菌-马萝卜过氧化物酶(SAv-HRP)
2. 程序
涂层
- 保持无菌状态,在层流罩内,将纯化的抗细胞因子捕获抗体稀释至无菌涂层缓冲液中最终浓度为0.5-4.0 μg/mL。(注:对于IFN-α和IL-6使用5μg/mL)。
- 将捕获抗体溶液 100 μL/孔转移到 ELISPOT 板。
- 用板盖盖住板并密封,以防止蒸发。
- 在4°C下孵育板过夜。
阻塞
- 第二天,在层流罩中揭开 ELISPOT 板。快速将板倒置到无菌湿巾上,从每个孔中取出捕获抗体溶液。
- 然后,在每个孔中加入200μL的细胞培养基。此步骤将阻止在测定期间进行非特定绑定。
- 更换板盖,在 37°C 下孵育板 2 小时。
电镀和激活细胞
- 在培养板时,在细胞培养基中制备含有50纳克/mL PMA和1μM碘霉素的2X线粒体溶液。
- 然后,将目标细胞悬浮液制备到2 x 106细胞/mL的库存浓度。
- 孵育完成后,通过快速将板倒置到层流罩内的无菌湿巾上,从每个孔中取出细胞培养基。
- 接下来,生成库存单元悬架溶液的 2 倍串行稀释。为此,首先将200 μL的制备蜂窝悬浮液添加到ELISPOT板顶行的井中。
- 然后,在包含细胞库存溶液的行下方的板的下五行中添加 100 μL 的普通细胞培养基。
- 之后,通过将细胞悬浮液的 100 μL 从顶行移入正下方的行,执行 2X 串行稀释。通过上下轻轻移液,确保正确混合,确保均匀分布电池。
- 对其余四行重复此过程。
- 仅保留第六行的区域性介质。它将作为实验控制。
- 接下来,将制备的线粒体溶液的100μL添加到板的前五行的实验井中。在对照井和第六行中,添加100μL的细胞培养基,不含线粒体。
- 在 37°C、5% CO2的培养箱中更换板盖和孵育板 20-48 小时。(注:20-24小时通常足以检测IL-2和TNF-α,而48小时对于IL-4和IFN-*是最佳选择。
检测
原抗体
- 制备生物仿当化抗细胞因子检测抗体,在测定稀释剂中浓度为2μg/mL。
- 此时通过在 PBS 中混合 0.05% 补间-20 来制备 20-25 mL 的洗涤缓冲液。
- 孵育完成后,解盖板,并迅速将其倒置在水槽上,以清除井中的所有液体。(注意:在此之后,板不再需要保持无菌)。
- 然后,通过在每个孔中加入±200 μL洗涤缓冲液来洗板。通过快速反转和轻拂水槽上的盘子来排出这种液体。重复此过程,共进行五次处理。
- 接下来,在每个井中加入100μL的稀释生物氨酸抗细胞因子检测抗体溶液。在室温下孵育2小时,室温下孵育,或在4°C下孵育。
二次抗体
- 孵育完成后,通过反转和轻拂水槽上的板来排出检测抗体。
- 与之前一样,用+200 μL洗涤缓冲液清洗板5次,每次洗涤之间排出液体。
- 接下来,在每口井中加入100 μ0μL的稀释链球蛋白-马萝卜过氧化物酶溶液(稀释到其预先确定的最佳浓度测定稀释剂中)。
- 更换板盖,在室温下在37°C下孵育1.5-2小时。
衬 底
- 孵育后,使用前不超过15分钟,根据制造商的说明首先激活AEC基板溶液。
- 接下来,丢弃井内的物品,像以前那样用洗涤缓冲液洗板五次。
- 然后,立即将100μL的制备AEC基板溶液加入每个井中。
- 在室温下孵育板约10-20分钟,同时监测现场发育。
- 用清水将盘子浸在水槽上,从而停止反应。
- 将盘子放在纸巾上,让盘子在一夜之间晾干,或直到完全干燥。取出板下的塑料托盘有助于干燥。
3. 数据采集和分析
- 干燥后,这些斑点已准备好使用自动板读取器计数。在这里,使用CTL免疫点读取器,但该协议可以适用于任何读取器。
- 首先打开仪器,然后打开计算机。然后,打开 CTL 程序并单击"扫描计数"。
- 推动"弹出"托盘从机器中伸出。然后,拆下塑料适配器,并在 ELISPOT 板和适配器上对齐行"A"。
- 选择要保存的文件的文件名和位置,并将板加载到托盘上。
- 然后,单击软件上的"加载"并关闭机器侧面的门。
- 按"计数后开始"。确保保存文件,然后打开质量控制"QC"软件来分析数据并计算点数。
笔记:
- 在初步实验中应确定细胞的最小数量。最佳点数为 +50/井。如果加载的单元格太多,将很难检测出不同的斑点。此外,细胞会重叠,可能不会在膜上形成单层,因此检测水平可能会降低。
- 优化实验时,考虑目标蛋白的预期表达水平。表达式越低,每口井所需的单元格数就越多。
- 与 ELISA 不同,最好用手洗盘子,而不是使用洗盘。ELISPOT板更细腻,应避免刺穿PVDF膜。
- 在孵育期间,应限制板块的运动,因为它可能导致斑点弄脏。
- 板应储存在黑暗中,因为暴露在直光下会导致斑点褪色。
酶相关的免疫点,或ELISPOT,分析病原体或细胞损伤的免疫反应的方法。它允许通过检测它们分泌的特定蛋白质来量化不同免疫细胞的激活。例如,ELISPOT 通常用于通过检测分泌的细胞因子来测量 T 细胞在暴露于异物抗原时的反应。
对于基于细胞因子的ELISPOT测定,该过程从ELISPOT微孔板的涂层开始,该微孔板具有捕获抗体,该抗体特定于目标细胞因子。抗体涂层后,T细胞被添加到井中,并通过外部剂(例如抗CD3抗体)刺激。细胞然后分泌目标细胞因子,该细胞因子立即被捕获抗体固定。由于蛋白质在分泌后从活细胞中立即捕获,没有稀释或降解,因此此测定具有高精度。目标细胞因子固定后,加入检测抗体,该抗体也与捕获的细胞因子结合。
ELISPOT 技术还可用于通过分析特定抗体的产生来量化感染或疫苗接种后的记忆 B 细胞。在基于抗体的ELISPOT中,使用特定的抗原代替抗体用于捕获步骤,抗原将结合到板中,或在检测步骤中,抗原在捕获后检测目标抗体。在该过程的所有变化中,对于T细胞或B细胞,检测抗体或抗原是生物仿当的,这使得它与链球蛋白结合的检测酶结合,如马萝卜过氧化物酶。然后,在添加过氧化物酶的基质AEC后,产生一种黑暗、不溶性沉淀物。这种沉淀标记捕获的蛋白质的位置,每个分泌细胞产生一个可见点,可以使用ELISPOT读取器或显微镜进行量化。斑点的大小是每个细胞分泌的蛋白质量的相对估计值。这种测定可以检测单个细胞的免疫反应,即使在相对较小的分泌细胞亚种群中,也可用于研究细胞层面的免疫反应。
在本视频中,您将学习如何执行 ELISPOT 测定,然后量化表示分泌细胞的点。
在整个实验中,通过在层流罩中工作并戴上手套,确保无菌条件。
此协议中的所有计算均基于一个 96 孔板所需的体积。
首先,稀释抗细胞因子捕获抗体。为此,将 10 毫升缓冲液转移到无菌的 15 毫升锥形管中。然后,使用移液器将10微升每毫升1毫克的单克隆抗体添加到缓冲液中,以创建最终浓度为每毫升1微克的溶液。接下来,将捕获抗体溶液倒入无菌储液罐中,并使用多通道移液器将 100 微升分配到 96 孔 ELISPOT 板的每个孔中。
用板盖盖住板,密封以防止蒸发,并在四摄氏度下孵育过夜。第二天,在层流罩中揭开 ELISPOT 板。快速将板倒置到无菌湿巾上,从每个孔中取出捕获抗体溶液。接下来,使用多通道移液器为每个孔添加 200 微升的细胞培养基。此步骤将阻止在测定期间进行非特定绑定。更换板盖,在 37 摄氏度的培养箱中孵育两小时。
在培养板时,通过在10毫升细胞培养基中加入一微升PMA和20微升的碘霉素,制备2X线粒体溶液,最终浓度达到每毫升PMA15毫微克和一微霉素。
此时,小鼠ssss的细胞悬浮液也应在无菌罩中准备。使用显微镜和血细胞计测量细胞的浓度并调整总体积,直到达到每毫升200万个细胞的库存浓度。
孵育完成后,迅速将板倒置到无菌湿巾上,从每个孔中取出细胞培养基。接下来,在 ELISPOT 板顶行的井中加入 200 微升的制备蜂窝悬浮液溶液。在三联设置实验,以便测试的每个单元格类型将镀在一组三个分组列中。在此下方,将 100 微升普通细胞培养基添加到下五行板中,在包含蜂窝库存溶液的行下方。
接下来,通过将 100 微升的电池悬浮液从顶行移入正下方的行,执行连续稀释,轻轻上下移液以均匀分布细胞。对其余行重复此过程,在每个步骤将 100 微升从上一行移动到下面的行,直到第五行被连续稀释。仅保留第六行与细胞培养基,以用作控件。为了刺激板的实验井中的细胞,在一排到五行的每口井中加入100微升制备的线粒体溶液。请务必离开第六行,这将作为控件,不受刺激。更换盖子,在 37 摄氏度和 5% CO2 下孵育板 24 至 48 小时。
准备稀释的生物氨酸抗细胞因子检测抗体。首先,通过将5毫升10%的胎儿牛血清加入45毫升的PBS,制备50毫升的测定稀释剂。接下来,将检测抗体稀释至测定稀释剂中每毫升2微克的浓度。此外,通过混合0.05%补间-20和PBS,此时准备20至25毫升的洗涤缓冲液。
孵育完成后,解开板的盖子,并迅速反转,从井中取出所有液体。通过在每口孔中加入约 200 微升的洗涤缓冲液来洗涤盘子。通过快速反转和轻拂水槽上的盘子来排出这种液体。重复此过程四次,共进行五次。接下来,在每个井中加入100微升的稀释检测抗体溶液,更换盖子,并在室温下孵育两小时。孵育后,通过反转板并在水槽上轻拂,将检测抗体溶液从板的孔中排出。
和以前一样,用洗涤缓冲液洗板五次,每次洗涤之间排出液体。最后洗涤后,根据制造商的说明稀释链球蛋白-马萝卜过氧化物酶溶液。接下来,在板的孔是空的,添加100微升稀释链球蛋白-马萝卜过氧化物酶溶液到每个井。将盖子放回盘子上,在室温下孵育两小时。
孵育后,使用前不超过15分钟,激活预制AEC基板溶液。丢弃井内的物品,用洗涤缓冲液洗碗五次,如前一样。然后,立即将100微升制备的AEC基板溶液加入每口井中。将板留在室温下发育约 10 到 20 分钟,同时监测斑点的发育。这些斑点在井面上显示为小而暗的圆圈。然后,停止反应,用水将盘子浸在水槽上。将盘子放在纸巾上,让空气干燥过夜或直到完全干燥。取出板下的塑料托盘有助于干燥。干燥后,这些斑点已准备好使用自动板读取器计数。
在这里,使用CTL免疫点读取器,但该协议可以适用于任何读取器。然后,打开 CTL 程序并单击"扫描计数"。将托盘的弹出从机器中伸出。然后,卸下塑料适配器,并在 ELISPOT 板和适配器上对齐行 A。选择要保存的文件的文件名和位置,并将板和适配器加载到托盘上。单击"加载软件"并关闭机器侧面的门。然后,按计数后开始。确保保存文件,然后打开质量控制 QC 软件来分析数据并计算点数。此数据作为 Excel 文件导出。分析完成后,单击"弹出"以检索板。
在实验中,对野生型和肿瘤小鼠的细胞进行了镀层和分析,以进行IFN伽玛分析。请注意,斑点的数量随着细胞浓度的降低而减少。通常,ELISPOT 数据以每镀电池数的点计数数的形式显示。在此示例中,点数显示在条形图中,每个细胞浓度都列在 x 轴上。请注意,点数表示给定总体中每个细胞总数激活的细胞数。
Subscription Required. Please recommend JoVE to your librarian.
Results
在本次ELISPOT测定中,对野生型和肿瘤小鼠的脾白细胞进行了分析,以检测IFN-α。图 2 A 显示了检测结果的可视图像。绿色数字表示每口井的点数(TNTC 表示"太多,无法计数")。请注意,斑点的数量随着细胞浓度的降低而减少。

图2A:肿瘤小鼠免疫反应下降。请点击此处查看此图的较大版本。
通常,ELISPOT 数据以每镀电池数的点计数数的形式显示。在图 2 B 中,点数显示在条形图中,每个各自的细胞浓度列在 X 轴上。出于绘图目的,150 用于指示最大点数。在肿瘤携带动物中产生鼠性精血白细胞的IFN-α数量低于野生型动物。

图2B:肿瘤小鼠免疫反应下降。从对照C57BL/6(野生型)和肿瘤携带小鼠中采集了双核细胞,用PMA/电霉素刺激48小时。ELISPOT测定法用于定量IFN-α-生产脾白细胞的数量。(A) 数据的可视化和 (B) 图形表示形式。TNTC 表示数量过多,无法计数。出于绘图目的,150 用于指示最大点数。绿色数字表示每口井计数的点数。红色数字表示用于确定哪些点是细胞以及哪些点是碎片、伪影或边缘效应的参考井,应排除在分析之外。
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
ELISPOT测定允许一个人通过确定分泌特定Anlyat的细胞数量来评估免疫细胞的激活。斑点的大小和强度提供有关每个细胞产生的麻醉剂量的信息。上述协议详细说明了单个细胞因子的检测。然而,最近的事态发展增强了这种测定的效用。目前,人们可以使用荧光检测染料来检测井内多个分析物。这允许检测分泌一种或两种分析物的细胞的不同亚群。
Subscription Required. Please recommend JoVE to your librarian.
References
- Czerkinsky, C. C., Nilsson, L. A., Nygren, H., Ouchterlony, O., & Tarkowski, A. A solid-phase enzyme-linked immunospot (ELISPOT) assay for enumeration of specific antibody-secreting cells. Journal of Immunological Methods, 65 (1), 109-121(1983).
- Wahid, R., Simon, J. K., Picking, W. L., Kotloff, K. L., Levine, M. M., & Sztein, M. B. Shigella antigen-specific B memory cells are associated with decreased disease severity in subjects challenged with wild-type Shigella flexneri 2a. Clinical Immunology, 148 (1), 35-43 (2013).
- Roberts, T. J., Lin, Y., Spence, P. M., Van Kaer, L., & Brutkiewicz, R. R. CD1d1-dependent control of the magnitude of an acute antiviral immune response. The Journal of Immunology, 172, 3454-3461 (2004).




