Overview
资料来源:苏珊娜·希斯勒1,托尼娅·韦伯1
1马里兰大学巴尔的摩分校微生物学和免疫学系,MD 21201
免疫沉淀(IP,也称为"下拉"测定)是一种广泛使用的技术,在各种领域都有应用。它于1984年首次构思,1988年经过提炼(1,2)。IP 的基本目标是使用针对该蛋白质的抗体对特定蛋白质进行纯化和分离。"免疫"一词是指使用抗体,而"沉淀"一词是指从溶液中拉出特定物质。目标蛋白可能是内源性或重组蛋白。大多数重组蛋白都有一个表位标记(即myc或标志)附着在它们上,以简化随后的纯化。通常,优化重组蛋白 IP 更容易,因为针对重组表位标记的抗体非常强和有效。针对内源性蛋白质的抗体具有极其可变的疗效 - 使得优化这些 IP 更加困难。免疫沉淀后的一个必要步骤是纯化验证。分离的蛋白质使用SDS-PAGE解决,随后由西方血带探查纯度(图1)。一个重要的控制是在西方印块期间使用不同的抗体来验证正确蛋白质的提取。IP 与后续技术的结合是一种强大的分析工具。纯化后的目标可能是通过NMR、质谱和体外测定对蛋白质本身进行表征,或分析蛋白质的相互作用伙伴(即蛋白质、DNA、RNA)(3、4、5)。
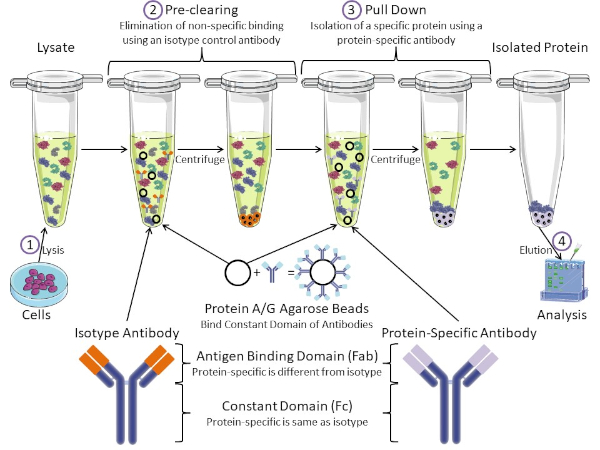
图1:免疫沉淀程序概述。免疫沉淀是使用抗体分离特定蛋白质。从细胞中生产分解后,有两个主要步骤-预清除和拉下。在预清除步骤中,细胞解物预先清除使用等型对照抗体与非特定抗体结合的蛋白质。在下拉步骤中,使用蛋白质特异性抗体将目标蛋白拉下。分离的蛋白质然后由西方斑点进行分析。等型抗体和蛋白质特异性抗体具有相同的恒定域,但抗原结合域不同。该协议的一个关键成分是蛋白质A/G腺珠,它结合抗体的恒定域-允许目标蛋白的免疫沉淀。请点击此处查看此图的较大版本。
抗体是免疫沉淀的关键成分,它区别于其他形式的蛋白质纯化(即镍亲基柱纯化)。抗体是由B细胞制成的分子,可以识别特定的蛋白质表皮。抗体有两个域:常数(Fc)和抗原结合(Fab)(图1)。常量域识别抗体的类型,并指示体内的功能。通常,用于IP的抗体的恒定域是小鼠、大鼠或兔子IgG。抗体的抗原结合部分识别特定蛋白质的特定表位。抗体可以识别折叠蛋白上的缩影,当蛋白质变性时,这些蛋白质可能不存在,反之亦然。因此,表位的可用性取决于蛋白质折叠 - 识别在选择抗体和IP条件时要考虑的重要因素。
原核素和真核系统都有抗体结合蛋白。在真核系统中,目的是免疫保护细菌,而在原核系统,目的是保护免疫系统。抗体结合蛋白以两种方式影响 IP 方法。首先,有必要的预清除步骤(图1)去除结合抗体的蛋白质的解结-从而减少最终产品中的非特异性结合。此步骤使用同型抗体,其恒定域与蛋白质特异性抗体不同,但抗体结合域不同。细菌抗体结合蛋白是该方法的第二个关键成分。在蛋白质特异性抗体结合靶蛋白后,抗体:蛋白质复合物必须被拉下(图1)。蛋白质A、G和L是结合抗体恒定领域的细菌蛋白。虽然细菌用它来破坏免疫系统,研究人员已经加入这个系统,以方便抗体纯化,它用于预清除和下拉步骤。这些蛋白质对于不同的物种和不同的恒定域亚型有不同的结合亲和力-在选择知识产权条件时需要考虑的另一个因素。许多公司销售标有A/G标记的甘蔗珠(图1)、预制旋转柱或树脂来制造柱。通常,珠子和旋转柱用于较小的样品尺寸,而树脂用于散装纯化。
在本实验练习中,我们演示如何使用基于蛋白质 A/G Plus 的腺苷酸腺苷酸细胞从原生鼠胸腺细胞中纯化内源性蛋白 c-myc。该协议从细胞分解液制备开始,最后通过西方斑点分析验证成功的蛋白质提取。
Procedure
1. 使用蛋白质 A/G PLUS 加蔗珠进行免疫沉淀
细胞莱沙处理
- 在13,000rpm的微离心机中将108胸腺细胞离心3分钟,并去除上清液。
注意:细胞数量将因所需蛋白质的表达水平和所选细胞类型而异。 - 用PMSF重新悬浮500μL裂化缓冲液RIPA中的细胞。
- 使用几个带涡旋的快速脉冲破坏细胞,然后用25G的针头在注射器上吸气几次。
注意:避免产生气泡。对于较大的细胞类型,请使用较大的针头(如 21G 针头)。 - 在冰上孵育细胞解乳10分钟。
- 在 13,000 rpm 转速下使莱沙在 4°C 下离心 15 分钟。
- 将上清液转移到新的,标记的微离心管。
预清除
- 向解毒剂中加入20μL蛋白A/G PLUS抗乳珠和1μg等型控制抗体(此处,使用小鼠IgG1等型控制抗体)。
注意:使用等型抗体的选择将取决于下拉步骤后面使用的蛋白质特异性抗体。 - 在冷室(4°C)的离心机旋转器上孵育解毒剂混合物30分钟。
- 在 3200 rpm 转速下将样品离心 30 s,在 4°C 下。
- 将预清除的上清液转移到新的,标记的1.5 mL微离心管。丢弃颗粒。
蛋白质浓度测定
- 通过执行布拉德福德测定测定,确定细胞莱沙的蛋白质浓度。
- 阿利胶1000μL布拉德福德试剂放入7个微离心管中。
- 将以下量的BSA蛋白标准(2mg/mL)加入6个管中(表1)。
| 管号 | BSA 体积 (μL) (2 毫克/升) | 蛋白质浓度(μg/μL) |
| 1 | 0 | 0 |
| 2 | 1 | 2 |
| 3 | 2 | 4 |
| 4 | 3 | 6 |
| 5 | 4 | 8 |
| 6 | 5 | 10 |
表 1:BSA蛋白质标准量
- 在第7管中,加入预清除的莱沙的1μL。
注意:为确保样品浓度在测定检测范围内,准备并分析1:2或1:5的莱沙稀释。 - 将 7 根管中的每根管中的 200 μL 放入平底 96 孔板的单个孔中,以三重层重复每个样品。
- 在 595 nm 的板读取板上读取板。
- 在 Excel 中生成标准曲线,并计算预清除的莱沙溶液的蛋白质浓度。
向下拉
- 将两个新鲜的 1.5 mL 微离心管标记为"控制",另一个标记为"测试",在此示例中为 c-myc。
- 将 500 μg 预清除的莱沙液放入每个管中。
注意:这里使用的蛋白质量取决于需要纯化的蛋白质的量。 - 使用莱沙缓冲液,将每根管的总体积调高至 500 μL。
- 在试组管中加入2μg抗c-霉素抗体,向对照组加入2μg小鼠IgG1等型对照抗体。
注:抗体的数量取决于抗体的疗效和目标蛋白的量。 - 在冷室(4°C)的旋转器上孵育管子2小时。
- 在每个管中加入20μL蛋白质A/G PLUS加加蔗珠。
注意:建议使用端切的移液器尖端,以防止损坏珠子。 - 在冷室(4°C)的旋转器上孵育过夜。
注意:根据靶蛋白和抗体的功效,此步骤从1小时到夜间不等。 - 在 3200 rpm 转速下将管在 30 s 4°C 下离心,以拉下珠子。
- 从每个管中吸出上清液。
注意:目标蛋白现在与珠子结合。 - 使用 500 μL 1X Dulbecco 的 PBS 清洗珠子两次。
- 在 3200 rpm 转速下将管在 30 s 4°C 下离心。
注意:对于更严格的洗涤,请使用更严格的缓冲液,如 RIPA。 - 从每个管中吸出缓冲液。使用凝胶加载技巧,从珠子中取出任何剩余缓冲液,并将珠子保存在冰上,以洗脱蛋白质。
注意:在此示例中,蛋白质通过沸腾珠子洗脱到SDS-PAGE运行缓冲液中,用于西方斑点分析。这种方法适用于验证 IP 结果或检查蛋白质-蛋白质相互作用。对于其他下游应用,如用于结构或酶分析的蛋白质的纯化,使用更复杂的系统,如表位标记(标记标记或霉菌标记)来避免与感兴趣的蛋白质的抗体洗脱。
2. 通过西布洛特分析进行知识产权验证
SDS-PAGE 电泳:
- 在含有β-梅卡托-乙醇的20μL SDS-PAGE加载染料中重新悬浮珠子。
- 将样品在95°C下煮5分钟。
- 在室温下,在 13,000 rpm 转速下将珠子离心 10 s。
- 使用凝胶加载技巧,仔细移液从珠子获得的样品,并将其加载到4-15%梯度SDS-PAGE凝胶的井中。
- 除了样品外,还装载带有蛋白质梯的车道以及带有预清除的莱沙的车道,以用作装载控制。
- 以 100 V 运行,直到染料正面到达凝胶底部(+1h)。
西布洛特分析:
- 制作西体三明治,确保PVDF膜在凝胶和红色阴极之间。
- 在 100 V 下传输 1 小时。
- 将膜置于室温下5 mL的阻滞缓冲液中,在低设置的摇臂上放置1小时,以阻止非特异性蛋白质结合位点。
注意:对于较大的血泡,可能需要增加阻塞缓冲液、原发抗体、二级抗体和洗液的体积。 - 在4°C的阻滞缓冲液中,用5 mL抗c-myc抗体在低设置下在摇臂上孵育。
注意:此处使用的抗体应不同于下拉步骤中使用的抗体。 - 使用 5 mL TBST 洗涤污点 3-6 次,在室温下,在低设置下,在摇臂上每次洗涤时间为 5 分钟。
- 用HRP标记的抗兔子光链二级抗体在阻隔缓冲液中孵育该斑点,在室温下在低设置下在摇臂上孵育1小时。
注意:二级抗体的选择将取决于用于西方斑点的原抗体。此外,在协议中使用了轻链特异性二次体,因为靶蛋白的分子量接近抗体的重链。如果目标蛋白接近50kDa,则使用光链特定的二次。如果目标蛋白接近25kDa,使用重链特异性二次。 - 使用 5 mL TBST 洗涤污点 3-6 次,在室温下,在低设置下,在摇臂上每次洗涤时间为 5 分钟。
- 从实验室湿巾上的斑点和 dab 边缘清除液体,以去除多余的液体。
- 用1x化学发光检测试剂盖住斑点,孵育1分钟。
注意:以下步骤应快速连续完成,因为检测试剂轻便且对时间敏感。 - 在实验室湿巾上涂抹斑点边缘,以去除多余的检测试剂。
- 将污点放在成像器托盘的成像表面上。
注意:化学发光的布有也可以用薄膜来可视化。 - 使用"化学发光程序"捕获从 10 秒到 5 分钟的多个时间点的图像。
注意:最佳时间可能会根据蛋白质数量和抗体质量而变化。 - 选择具有最佳波段可见性的图像,然后导出该图像。
- 在移动污点之前,使用成像器拍摄污点的照片,以捕获梯子的位置。然后,也导出该图像。
- 使用幻灯片准备软件(如 PowerPoint),对齐波段和梯形图像以形成单个图像。
免疫沉淀,或IP,是一种广泛使用的技术,从细胞或组织液中分离感兴趣的蛋白质或体液,用于蛋白质表征或研究蛋白质-蛋白质相互作用。
这个过程从抗体开始,抗体对靶蛋白具有很高的亲和力和特异性。该抗体与样品混合,允许形成抗体靶向复合物。与目标蛋白结合的任何蛋白质也在这个过程中间接附着在抗体上。接下来,该溶液与与细菌蛋白结合的甘蔗珠孵育,对抗体的恒定区域有很强的亲和力。细菌蛋白与抗体结合,并将抗体靶向复合物与珠子连接。然后,对溶液进行离心以沉淀珠子,从而提取包含结合抗体、靶蛋白和任何相互作用蛋白的整个复合物。最后,从珠子中提取结合蛋白,相互释放,通过西印等技术进行进一步分析。
该技术的不同部分的几种变体被普遍使用,如预清除、使用肽标记或磁珠,或分析其他非蛋白结合伙伴。IP 可以通过预清除步骤来预先发现,以去除样品中的非特异性抗体结合蛋白并最小化背景。这涉及首先用等型对照抗体孵育样品,允许它们与这些蛋白质结合,然后使用腺珠来沉淀复合物。然后,该示例已准备好继续到实际 IP。
如果特定抗体不适用于 IP,肽标记非常有用。在这里,靶蛋白可以进行基因改造,以包含肽表位标记,而针对该标记的抗体能够提取感兴趣的蛋白质。磁珠通常用代替甘蔗来沉淀目标。与抗体靶向复合物结合后,样品管被放置在强磁场中,从溶液中提取珠子。这消除了离心的需要,提高了速度和便利性。
免疫沉淀也用于研究DNA或RNA结合蛋白,分别称为染色质免疫沉淀和RNA免疫沉淀。这些变体可用于针对不同的实验应用进行故障排除和调整方法。在本视频中,您将观察如何预先清除细胞解液并执行免疫沉淀以提取感兴趣的蛋白质,然后进行西方污点分析以验证实验。
首先,将预收集的细胞置于微离心机中,以13000rpm转速旋转三分钟。旋转后,取出上清液,然后用PMSF将细胞重新悬浮在500微升的裂变缓冲RIPA中。现在,使用几个带有漩涡的快速脉冲破坏细胞,然后用25号针连接到注射器吸气几次,注意避免产生气泡。将细胞放在冰上15分钟。在冰上孵育样品后,在4摄氏度的温度下将莱沙发生15分钟的离心机。
标记一个新的1.5毫升微离心管。旋转后,将上清液转移到新标记的管子上,然后丢弃颗粒。接下来,通过在解结中加入 20 微升的蛋白质 A/G PLUS-agarose 珠和一个同型对照抗体的微克,预先清除非特有结合到角胶珠或原抗体的污染物的解结。例如鼠标 IgG1 等向控件。在冷室的旋转器上孵育管子30分钟。在冷室中旋转了30分钟后,在3200rpm转速下将样品离心30秒,温度为4摄氏度。从离心机中取出管,并将预清除的上清液转移到新的标记为 1.5 毫升的微离心管中。丢弃颗粒。
现在,通过执行布拉德福德测定测定细胞莱沙酸的蛋白质浓度。标签七 1。5毫升微离心管一到六,样品和等分1000微升的布拉德福德试剂进入每个管。六个管将用于通过在每个管中添加各种数量的已知BSA来构成标准曲线。要添加的金额列在此表中。在第七个样品管中,加入一微升的预清除莱沙。将七根管子中的200微升放入平底96孔板的单独井中,重复三重样品,使七个样品中有三列。使用 595 纳米的波长读取板读取板上的板。在 Excel 中创建标准曲线后,计算预清除的莱沙的蛋白质浓度。
接下来,将两个1.5毫升的微离心管标记为控制,另一个作为测试,在此示例中,它将是c-myc抗体。将500微克的预清除莱沙液放入每个管中,然后用莱沙缓冲液将每管的总体积达到500微升。接下来,在测试组管中加入两微克的抗c-myc抗体。对于对照组,添加两微克小鼠IgG1等型对照抗体。一旦抗体被添加到管中,将样品放在冷室的旋转器上,孵育两小时。现在,添加腺珠。为此,建议切断移液器尖端的末端,然后,使用此改性尖端,在每个管中加入 200 微升的蛋白质 A/G PLUS-agarose 珠子。在寒冷的房间里过夜,在旋转器上孵育管子。
孵育后,从旋转器中取出管子,旋转微离心机中的分解物以拉下珠子。旋转完成后,从离心机中取出管子,并从每个管中吸出上清液。接下来,用 500 微升的 1X Dulbecco 的 PBS 清洗珠子。将管子放在微型离心机中,在4摄氏度下旋转30秒。接下来,删除上清液。重复清洗和离心机步骤一次共两次。从微离心机中取出管子,并从每个管中吸出缓冲液。使用凝胶加载技巧,从珠子上去除任何留在缓冲液上,将珠子留在冰上,使结合的蛋白质脱脂。
在此示例中,通过沸腾进行西方斑点分析,将蛋白质洗脱到 SDS-PAGE 运行缓冲液中。为此,将含有β-汞醇(BME)的20微升SDS-PAGE加载染料中重新悬浮。将样品在95摄氏度下煮沸5分钟,使免疫复合物与珠子分离。然后,在室温下以最大速度将珠子离心10秒。从微型离心机中取出管子,并在室温下将其放在机架中。使用凝胶加载头,小心移液从珠子样品,并加载到4至15%梯度SDS-PAGE凝胶的井。除了样品外,还装载带有蛋白质梯的车道以及带有预清除的莱沙的车道,以用作装载控制。一旦凝胶加载,运行凝胶在100伏特。
染料正面到达凝胶底部后,大约需要一个小时,停止凝胶并制作西印体三明治,确保PVDF膜位于凝胶和阴极之间。将西印体三明治放入转移装置中,在100伏特下将凝胶上的蛋白质转移到膜上一小时。转移完成后,将膜置于五毫升的块中,以防止抗体非特立结合膜。在室温下在低温度下摇动一小时。当计时器响起时,删除阻塞缓冲区。在膜中加入五毫升的阻滞缓冲液,并加入检测抗体。在这里,使用一种与下拉的抗体不同的抗c-myc抗体。
在夜间孵育斑点,在低环境的摇臂上摄氏四度。孵育后,取出抗体并阻塞缓冲液。在室温下,在低设置的摇杆上清洗斑点,在室温下使用五毫升的TBST五分钟。这种洗涤步骤应重复两到五次,共三到六次洗涤,每次洗涤使用新鲜的TBST。加入5毫升的1至1000二次抗体,并阻止缓冲液到斑点。在这种情况下,二次抗体是HRP标记的抗兔光链。在室温下,在低设置下在摇杆上孵育斑点。接下来,取出缓冲液,用五毫升的TBST洗去污液。在室温下,在低设置下在摇杆上孵育此洗涤液五分钟。重复这种洗涤共6至12洗,每个与新鲜的5毫升的TBST。先将液体从污液中浇注,取出最终洗涤液。然后,使用钳子,在实验室擦拭上涂抹斑点的边缘,去除多余的液体,然后将污液放入一个新的容器中。接下来,用1倍化学发光检测试剂覆盖斑点,孵育一分钟。
快速工作,在实验室擦拭上涂抹斑点的边缘,取出任何多余的检测试剂,然后将污点放在成像器托盘的成像表面上。使用化学发光程序捕获 10 到 30 秒的多个时间点的图像。对污点进行成像后,选择具有最佳波段可见性的图像,然后导出该图像。在移动污点之前,使用成像器拍摄污点的照片以捕获梯子的位置。然后,也导出该图像。最后,使用幻灯片准备软件(如 PowerPoint)将波段和梯形图像对齐以形成一个图像。
这张图片显示了从胸腺细胞中免疫沉淀蛋白质c-myc的西方斑点结果。从左到右,通道表示等型控制、c-myc IP 和预先清除的裂化输入。最右边的车道是分子量梯的合并图像。强带,在25千道尔顿左右来自轻链,一个在50千道尔顿是从结合抗体的重链,是非特定于IP或样品。C-myc在西斑上运行约67千吨,通常可以看到在75千道尔顿梯带以下。在此印块中,c-myc 波段在第二条通道中可见,但在第一通道中不存在,表明 IP 抗体成功拉下 c-myc。在预清除的莱沙内巷没有可见的带状,这表明这种蛋白质具有低内源表达水平。
Subscription Required. Please recommend JoVE to your librarian.
Results
上文详细介绍的过程结果如图 2 所示。从左到右,通道包含对照组(等型)、测试组(c-myc)、预清除裂化(裂化)和分子量阶梯(阶梯)。标记了 25 和 75 kDa 梯子带。#25 kDa 和 50 kDa 的两个突出带分别是结合抗体的轻链和重链,并且对 IP 或样品不特定。c-myc蛋白在西斑上运行约67kDa,通常在75 kDa梯带下方可见。在此印贝中,c-myc 波段在第二条通道中可见,但在第一通道中不存在,表明 IP 抗体成功拉下 c-myc。在预清除的莱沙内巷没有可见的带状,这表明这种蛋白质具有低内源表达水平。

图2:西带分析的结果,用于评估免疫沉淀对c-myc的纯化。67 kDa 的频段对应于 c-myc,在防 c-myc 通道中可见,但在等型控制通道中不可见。请注意,c-myc 水平不够高,无法在莱沙通道中可视化。请点击此处查看此图的较大版本。
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
简而言之,免疫沉淀是使用抗体分离特定蛋白质。在本例中,通过西方污点分析免疫沉淀的结果,以评估纯度。分离的蛋白质可用于随后的多种应用,包括:用于蛋白质结构的NMR、氨基酸序列的质谱法或用于酶表征的体外测定。IP 还可以描述蛋白质的相互作用伙伴的特征。例如,在分离后,DNA或RNA可以分离进行测序。共免疫沉淀评估蛋白质-蛋白质的相互作用。当目标蛋白在IP过程中被拉下时,相互作用的蛋白质也可以被拉下来。这些相互作用的伙伴可以通过质谱和西方斑点进行评估。免疫沉淀是研究蛋白质生物学的有力技术。
Subscription Required. Please recommend JoVE to your librarian.
References
- Olliver, C. L. and Boyd, C. D. (1984). Immunoprecipitation of In Vitro Translation Products with Protein A Bound to Sepharose. In J. M. Walker (eds), Nucleic Acids. Methods in Molecular Biology (pp. 157-160). New Jersey: Humana Press.
- Thurston, C. F. and Henley, L. F. (1988). Direct Immunoprecipitation of Protein. In J. M. Walker (eds), New Protein Techniques. Methods in Molecular Biology (pp. 149-158). New Jersey: Humana Press.
- Anderson, N. G. (1998). Co-immunoprecipitation: Identification of Interacting Proteins. In R. A. Clegg (eds), Protein Targeting Protocols.Methods in Molecular Biology (pp. 35-45). New Jersey: Humana Press.
- Jackson, D. I. and Dickson, C. (1999). Protein Techniques: Immunoprecipitation, In Vitro Kinase Assays, and Western Blotting. In P.T. Sharpe and I. Mason (eds), Molecular Embryology. Methods in Molecular Biology (pp. 699-708). New Jersey: Humana Press.
- Trieu, E. P. and Targoff, I. N. (2015). Immunoprecipitation: Western Blot for Proteins of Low Abundance. In B. Kurien and R. Scofield (eds), Western Blotting. Methods in Molecular Biology (pp. 327-342). New York, NY: Humana Press.




