Overview
ソース: アンナ・ブレックバーグ1, ロルフ・ルード1
1臨床科学ルンド, 感染医学の部門, ルンド大学生物医学センター, 221 00 ルンドスウェーデン
微生物が抗生物質耐性をどのように進化させるかを理解する上で、抗生物質と細菌の相互作用に関する知識が重要である。1928年、アレクサンダー・フレミングは、細胞壁再生を妨げ、抗菌機能を発揮する抗生物質であるペニシリンを発見しました(1)。その後、細菌のDNA複製やタンパク質翻訳を阻害する薬剤を含む、多様な作用機序を持つ他の抗生物質が発見された。しかし、近年、新しい抗生物質は開発されていない。現在の抗生物質に対する耐性が高まり、効果的に治療できない重篤な感染症が生じています(2)。ここでは、細菌集団における抗生物質耐性を評価するいくつかの方法について説明する。これらの方法のそれぞれは、使用される抗生物質の作用機序にかかわらず、細菌死が測定された結果であるため、機能する。抗生物質耐性は、病院の設定を通じて特に急速に広がるだけでなく、社会全体に広がっています。このような抵抗手段を調べるために、エプシロメータ試験(E検定)やブロス希釈試験(3)を含む様々な方法が開発されている。
E検定は確立された方法であり、微生物の目に見える成長を阻害する抗菌剤の最低濃度である最小限の阻害濃度(MIC)データを定量する費用対効果の高いツールです。使用される細菌株および抗生物質によって、MIC値はサブμg/mLから>1000 μg/mL(4)の間で変化する可能性がある。E検定は、あらかじめ定義された抗生物質勾配を含むプラスチックストリップを使用して行われ、これはμg/mLでMIC読み取りスケールが刻印されています。このストリップは、接種された寒天プレートに適用される場合、寒天マトリックス上で直接転送されます。インキュベーション後、細菌の増殖が防止されるにつれて、対称的な楕円阻害ゾーンがストリップに沿って見える。MIC は、楕円がストリップと交差する終点である阻害の領域によって定義されます。MICを決定するもう一つの一般的な方法は、マイクロブロス希釈法である。マイクロブロス希釈は、接種細菌を含むブロス培地に添加された抗菌剤の異なる濃度を組み込む。インキュベーション後、MICは目に見える成長を防ぐ抗生物質の最も低濃度として定義される(5)。また、定量的な方法であり、いくつかの細菌に適用することができます。この方法の欠点は、試薬の濃度と実験に必要な試薬の数が多い場合にエラーが発生する可能性があることです。抗生物質耐性の測定は、臨床および研究の両方の観点から不可欠であり、耐性を調査するこれらのインビトロ法について以下に説明します。
特定の細菌に対する抵抗性のプロファイルは、患者が併用治療と単一療法のどちらから利益を得るかを決定するために抗生物質治療を最適化するために適用することができる。一度に複数の抗生物質を使用するためには、互いの相互作用を知ることが不可欠であり、それらが添加剤、相乗的、または拮抗効果を有するかどうかを知ることが不可欠です。抗生物質の関節効果が等しい用量で与えられた個々の抗生物質の効力に等しい場合、添加効果が見られます。一方、抗生物質間の相乗効果は、薬剤が単独で与えられる場合よりも抗生物質の関節効果がより強力である場合に存在する(6)。抗菌治療の組み合わせを適用することは、このように個々の抗生物質治療の効果を高めるために抗菌性の発生を回避するために使用される(7)。抗菌性の知識は、抗菌の組み合わせの不必要な使用を防ぐためにも重要です。E検定方法論は、異なる抗菌剤間の可能な相乗効果と拮抗作用を決定するための簡単かついくつかの方法を提供する。抗生物質耐性病原体の増殖に直面するためには、特定の抗生物質の相乗的および拮抗的なメカニズムの可能性に関する知識が重要であり、臨床的有効性および多剤耐性との闘いをもたらす。
E検定を用いたシナジーの決定は、クロステストと非クロステストの2つの大きなアプローチに分けられます。いずれの相乗効果テストも、個々のMIC値に関する以前の知識に依存していますが、この2つのアプローチは方法論と概念的アプローチにおいて若干異なります。非クロスシナジー試験では、試験対象のペアの最初の抗生物質が細菌に接種された寒天板上に置かれる。最初のストリップからの抗生物質がプレートを注入することを許可した後(例えば、1時間後)、ストリップが除去され、2番目の抗生物質を含む新しいストリップが最初のとまったく同じ場所に置かれ、各otの上に2つの個々のMIC値を置くことを確認します。彼女。得られた阻害ゾーンは、上記のように分析することができ、式1に基づいて計算された相乗効果。
式 1 - 分数阻害濃度 (FIC)
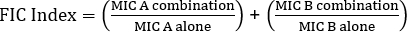
値 >0.5 は相乗効果を示します。
分析しやすいプレートで試験官に報酬を与える一方で、ストリップの変更や実験ごとに2枚のプレートを使用する必要性により、多少手間と時間がかかります。代わりに、クロステストが使用されることがよくあります。2つの異なるE検定ストリップを互いに上に追加する代わりに(最初の除去後)、両方が同時に配置されますが、クロス(90° 角度)の形で、以前に決定された2つのMIC値が90°角度を形成します。このアプローチでは、シナジーテストごとに1つのプレートのみが必要であり、作業が少ないため、分析が少し難しいにもかかわらず、好ましい選択になります。組み合わせた抗生物質アプローチにおける新しいMIC値は、修飾阻害ゾーンとして視覚化することができ、その後、相乗効果は式1によって決定することができる。
角度)の形で、以前に決定された2つのMIC値が90°角度を形成します。このアプローチでは、シナジーテストごとに1つのプレートのみが必要であり、作業が少ないため、分析が少し難しいにもかかわらず、好ましい選択になります。組み合わせた抗生物質アプローチにおける新しいMIC値は、修飾阻害ゾーンとして視覚化することができ、その後、相乗効果は式1によって決定することができる。
寒天プレートアプローチを使用する代わりに、マイクロブロスアプローチは、多くの場合、その柔軟性が高いため優先することができます(例えば、E検定ストリップの限界外の抗生物質の特定の濃度を選択する能力)。また、固相内の解離に依存しない液体溶液中の抗生物質の均一な分布のために、マイクロブロス検査はより敏感であることが示唆される。.96ウェルマイクロプレートのウェルは、一定数の細菌(106 cfu/mL:細菌濃度はOD600nm測定、濁り基準、または10倍の細菌連続希釈からめっきサンプルを広げることによって推定することができる)で接種され、および異なる希釈の抗生物質が井戸に加えられる。同様に、E検定ストリップにMICは、細菌の目に見える増殖を阻害する抗生物質の最も低濃度との交点(ウェル/スポット)として決定される。
実験的な目的
- 以下のプロジェクトは、ペニシリンGと連鎖球菌群GのゲンタマイシンのMIC値を、E検定およびマイクロブロス希釈の2つの異なる方法によって決定する戦略について説明する。E検定では、ストレプトコッカス群Gに接種したミューラー・ヒントン寒天プレートをペニシリンGおよび/またはゲンタマイシンの勾配ストリップと組み合わせて使用した。50%溶解した馬の血液と20mg/mL β-NADを用いたMH-ブロスは、マイクロブロスアプローチでストレプトコッカス群Gと共に可溶性抗生物質と共に使用した。
材料
- 血液寒天プレート上の細菌コロニー、4°Cで保存<7日
- 血の寒天プレート
- 0.5 マクファーランド標準
- 1% バクル2
- 1% H2SO4
- 生理生理管(2 mL)
- コットンチップアプリケーター
- ミューラー・ヒントン寒天プレート(MHAプレート)
- 50%のライズ馬の血液と20 mg/mL β-NAD(MH-F)のMHスープ
- E検定ペニシリン/ゲンタマイシン(または目的の抗生物質)(BioMerieux、マーシー・レトワール、フランス、スウェーデン)
- ペニシリン/ゲンタマイシン(または目的の抗生物質(粉末/溶液))
注:細菌の増殖に使用される特定の培地は、種によって異なる場合があります。
Procedure
1. エプシロメーター試験(E検定)
-
セットアップ
- 手袋とラボコートを着用する
- 70%エタノールを使用して殺菌してワークスペースを準備
- ミュラー・ヒントン寒天プレート(MHAプレート)を収集
-
マクファーランド濁度規格No.0.5の準備
- 塩化バリウム(BaCl2)の1%溶液を調調します。
100mL蒸留水に1グラムの無水バリウム塩化バリウム(BaCl2)を加えます。渦がよく。 - 硫酸の1%溶液を調出す(H2SO4):
蒸留水の99 mLに濃縮H2SO4の1 mLを加えます。渦がよく。 - マクファーランドの濁り標準番号0.5を準備します。
1%H2 SO4溶液の5mLで50 μL BaCl2溶液。濁った懸濁液を得るためによく解決策を渦。 - ホイルで覆われた管の中のMcFarlandの濁りの標準No.0.5を保つ。最大6ヶ月間25°Cで保管してください。使用前に均質な溶液によく渦。
- 塩化バリウム(BaCl2)の1%溶液を調調します。
-
MHAプレートの準備
- 無菌ループを用いて血液寒天板からスクレープストレプトコッカス群G細菌。生理生理生理の1mLに混合し、細菌の懸濁液に渦。
- 実験中に同じ接種サイズを持つために、同じ濁りを達成するために、マクファーランド標準No.0.5とサスペンションを比較します。追加の生理生理生理知または細菌を使用して濃度を調整します。
- 無菌綿の先端アプリケーターを使用してMHAプレートを接種します。プレートをそっと洗って表面を覆います。以下に説明する 3 つの方法のいずれかに進みます (1.4-1.6)。
-
単一の抗生物質耐性試験。 連鎖球菌群G、ペニシリンGまたはゲンタマイシンに対する耐性
- MHAプレートの中央にE検定ストリップ(ペニシリンGまたはゲンタマイシン)を置きます(図1 A,B)。
- 18-20時間、37°Cのインキュベート。
- 結果を読んでください。MICは、等級付き抗生物質試験帯と交差する阻害ゾーンとして測定される(図1 C,D)。

図1:単一E検定。A)ペニシリンGおよびB)のE検定ストリップの配置(AおよびB)の前に(AおよびB)および後(CおよびD)一晩のグループG連鎖球菌の細菌コロニーで覆われたミューラー・ヒントン寒天板上のゲンタマイシン37°Cでのインキュベーション 5% CO2.この図のより大きなバージョンを表示するには、ここをクリックしてください。
-
シナジーテストのクロスアプローチ。連鎖球菌群Gは、ペニシリンGおよびゲンタマイシンに対する耐性である。
- 異なる抗生物質(例えばペニシリンGおよびゲンタマイシン)を含む2つのE検定ストリップを、クロス形成中の接種されたMHAプレートに置きます。
- 最も正確な結果を出すには、単一の抗生物質耐性試験で以前に決定されたMIC値でのスケール間の交点に約90°の角度で十字を配置することを目指す(図2A)。
- 一部の抗生物質は既にプレートに吸収されている可能性があるため、ストリップを寒天プレート上に置くと、それらは移動しないでください。したがって、ストリップをわずかに間違った角度(例えば85°)で維持し、実際のMIC値から最大1〜2mmに維持することがより適切です。この問題を軽減するために、実験を三色にすることをお勧めします。
- 18-20時間、37°Cのインキュベート。
- 結果を読んでください。MICは、それぞれのE検定ストリップ上の等級付き抗生物質試験ストリップと交差する阻害ゾーンとして測定される(図2B)。
- 相乗効果を決定するために、分画抑制濃度(FIC)(式1)の式を使用します。
- 異なる抗生物質(例えばペニシリンGおよびゲンタマイシン)を含む2つのE検定ストリップを、クロス形成中の接種されたMHAプレートに置きます。

図2:相乗効果検出-クロステスト。連鎖球菌群GのペニシリンGおよびゲンタマイシンのMICの抗菌相乗効果試験の結果(A)及び(B)インキュベーションを37°C 5%CO2で一晩インキュベーションした。2つの個々のMIC値(ペニシリンG:0.094 μg/mL、ゲンタマイシン:8 μg/mL)の間に90°の角度が形成されます。この図のより大きなバージョンを表示するには、ここをクリックしてください。
-
シナジーテスト非クロスアプローチ。連鎖球菌群Gは、ペニシリンGおよびゲンタマイシンに対する耐性である。
- EテストストリップをMHAプレートの中央に配置します(図3 A,D)。
- 以前に決定された MIC 値が各ストリップ上のどこにあったかをマークします。
- 室温で1時間インキュベートする。
- 各MHAプレートのEテストストリップを破棄します(図3 B,E)。
- MIC 値がマークに対応し、整列するように、2 番目の E 検定ストリップ (異なる抗生物質を含む) を以前に削除したストリップの領域にそれぞれ配置します。
- 18-20時間、37°Cのインキュベート。
- 結果を読んでください。MICは、それぞれのE検定ストリップ上の等級付き抗生物質試験ストリップと交差する阻害ゾーンとして測定される(図3 C,F)。
- 相乗効果を決定するために、分画阻害濃度(FIC)の式が用いられる(式1)。

図 3: 相乗効果検出 - 非クロステスト。連鎖球菌群G.A)レンタマイシンストリップ(8μg/mL中心)のペニシリンGおよびゲンタマイシンのMICの抗菌相乗効果試験の結果(8μg/mL中心)ストレプトコッカス群G細菌の上に、B)ゲンタマイシンストリップ、Cの除去)ストレプトコッカス群G細菌、D)ペニシリンGストリップ(0.094 μg/mL中心)の上にゲンタミシン/ペニシリンGストリップ(0.094 μg/mL中心)、E)ペニシリンGストリップ、F)複合ペニシリンG/の除去レンタマイシンストリップ(8 μg/mL中心)をストレプトコッカス群G細菌の上に置く。この図のより大きなバージョンを表示するには、ここをクリックしてください。
2. ブロス試験
-
セットアップ
- 手袋とラボコートを着用する
- 70%エタノールを使用して殺菌してワークスペースを準備
- 50%のライズされた馬の血および20 mg/mL β-NAD(MH-F)と15mL MHのスープを集める
-
(オプション)E検定[プロトコル1]を実行して、固体媒体上のMICを決定する
- オプションですが、このような知識は、より良い実験設計を可能にします(例えば、追加された抗生物質の濃度は、プレートから決定されたMIC値を囲むように設計することができ、実験が成功する可能性を向上させる)。
-
細菌の接種を準備する。前述のように、細菌濃度はOD nm測定またはマクファーランド濁度基準によって推定することができる
-
OD600 nm法
- 確立された細菌濃度で細菌懸濁液を得る
- 0.003のOD600を達成するためにMH-Fスープの培養を希釈する
-
マクファーランド濁度法
- 無菌チューブに15 mL MH-Fスープを入れます。
- MH-Fスープを(プレートから)マクファーランドレベルに細菌で接種します。溶液を精力的に渦に入れ。無菌ペトリ皿に溶液を注ぎます。
-
OD600 nm法
-
抗生物質の準備
- 必要な抗生物質の濃度を決定する
- E-検定からMIC値を特定する(ペニシリンGの場合は0.125 μg/mL、ゲンタマイシンは8μg/mL)
- 寒天板MIC値に24-27を掛け、4-7 2xシリアル希釈に対応します。これは抗生物質の開始濃度になります。(ペニシリンG、7つの2xシリアル希釈:0.125 μg/mL x 27 = 16 μg/mL;ゲンタマイシンの場合、4つの2xシリアル希釈8 μg/mL x 24 = 128 μg/mL
- 抗生物質のストック濃度を生成するために所望の開始値100倍を乗算する(例えば1.6 mg/mLペニシリンGおよび12.8 mg/mLゲンタマイシンの株式)
- それに応じて100倍の抗生物質ストック濃度を準備する
- 10mLオートクレーブ水に抗生物質を溶解し、ボルテックスを生成するために、ストック溶液を生成する(例えば16mgペニシリンGと128mgゲンタマイシンは、上記の株式を作成するために)
- 必要な抗生物質の濃度を決定する
-
マイクロプレートウェルに細菌を追加
- アリコット200 μl MH-Fブロスは、三重の実験のための96ウェルマイクロチタープレートの最初の3列のウェルに細菌の接種を含有する。
-
マイクロプレートウェルに抗生物質を追加
- ウェルの最初のカラム(A1、B1、C1)に細菌を含む200μLの余分なMH-Fスープを追加し、総体積を400μLにします。
- ウェルの最初の列に抗生物質のストック濃度の4 μLを追加します。サンプルには400 μLが含まれているため、抗生物質の100倍の希釈が生じる。
- A1からA2に200 μL細菌/抗生物質をA11に移すことによって2倍の連続希釈を生成する。希釈の間に激しくピペット。追加の行の手順を繰り返します。
- すべてのウェルの最終容積が200 μLになるように、カラム11から200 μLを取り外します。
- 最後の列(A12、B12、C12)は、抗生物質なしで、コントロールとして残します。
-
MIC 値の決定
- 96ウェルマイクロチタープレートを37°Cで24時間、揺らさずにインキュベートします。
- MIC値は、細菌の目に見える増殖を示さない希釈系列の最後の井戸として定義される(図4)。ただし、この値は、元のイノクル サイズが正しい場合にのみ信頼できます。

図4:ブロス希釈によるMIC判定。MICは、濁りを変化させる前に透明度(細菌の増殖なし)を示す最後の井戸として定義されています。行はペニシリンGのMIC値の複製であり、行はゲンタマイシンのMIC値の複製であり、いずれもストレプトコッカスグループG.Aの単離と比較して、実際の実験結果、B)Aからの値の概略解釈(灰色 = 成長なし;白=成長)。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図5:元の細菌濃度をカウントする希釈系列の概略手順。希釈は記載されているように(10x希釈系列に対して180μLで希釈した20μL)、次いでA-H行から10μLが示すように2つの別々の血液寒天プレートにめっきされる。この図のより大きなバージョンを表示するには、ここをクリックしてください。
-
元のイヌキュラムサイズを決定する
注:マイクロブロスアッセイは、使用される元の接種サイズに対して非常に敏感です。過剰な接種サイズは、追加された抗生物質は、もはやその比率で成長を阻害することができないので、偽陽性の結果を与えます。したがって、マイクロウェルにどの程度の細菌が追加されたかを確認することが重要です。データは実験の時点では利用できませんが(24時間インキュベーションが必要なため)、コントロールとして機能します。添加された細菌の数が記載された濃度範囲内にある場合、MIC値を信頼できます。接種が高すぎるか低すぎる場合は、実験を繰り返す必要があります。-
細菌を連続的に希釈する
- 96ウェルマイクロティタープレートを調製し、元の細菌濃度を希釈して接種サイズを決定する。最適は105-6細菌と200 μLの容積である。希釈を行うために、まずアリコート180μL滅菌PBSをB-Hの各ウェルに(三重1-3)。
- 次に、100 μlの細菌溶液をAに加える(三量三分の1-3)。
- 20μlの細菌をAからBに移し、ピペを激しく移送して10倍の連続希釈(三重)を生成します。C-H の手順を繰り返します。
-
接種サイズ決定のための細菌希釈をプレート化
- 図 5に従って血の寒天プレートをマークします。
- 図 5に従って、シリアル希釈からプレートに 10 μL を転送します。
- プレートを37°Cで20~24時間インキュベートします。
-
細菌の接種サイズを決定する
- 5~50コロニー内のスポット内の細菌数を数える(図6)。
- トリプリケートサンプルの平均を計算して初期の接種サイズを計算し、希釈係数を増算し、希釈係数(例えばBサンプルの場合は100倍、Cサンプルの場合は1000倍、Dサンプルの場合は1000倍)を乗算し、10μLのスポッティング量を補正します。cfu/mLの接種サイズ。接種が105-6 cfu/mL内にある場合、MICデータは信頼できます。
-
細菌を連続的に希釈する

図6:接種サイズの決定。図5に従って接種した細菌を37°Cで20〜24時間インキュベートし、次いでカウントした。行 D には、数えるコロニーの数が多い (例: 5~ 50) があります。Aの試料は希釈されず、Bは10倍、Cは100倍希釈され、Dは1000倍希釈され、各スポットで10μLのみがめっきされる。この図のより大きなバージョンを表示するには、ここをクリックしてください。
抗生物質感受性は、抗生物質に対する細菌の感受性として定義され、スープ希釈試験またはエプシロメーター試験(E検定とも呼ばれる)を使用して測定することができる。
ブロス希釈法では、シリアル抗生物質希釈を含む増殖培地に標準化された数の細菌が添加される。感受性がある場合、細菌は高い抗生物質濃度で増殖することはできませんが、より低い抗生物質濃度で増殖し続け、培方が濁る原因となる。細菌がもはや生き残ることができない、または増殖できない最も低い抗生物質濃度は、与えられた細菌に対する抗生物質の最小抑制濃度、またはMICと呼ばれる。
E検定では、あらかじめ定義された抗生物質の勾配を含浸させたプラスチックストリップが、ミューラー・ヒントン寒天、またはMH-Aペトリプレート上の細菌の新たに広がった芝生の上に適用される。抗生物質は寒天媒体に拡散し、そこで細菌によって取り込かれる。感受性が高い場合、細菌は増殖することができず、死んでしまい、Eストリップの周りに明確なゾーンを形成し、成長抑制ゾーンと呼ばれる。成長がEストリップと交差する時点で、スケール上の対応する値は、抗生物質のMIC値を与える。
多くの場合、抗生物質は、細菌の抗生物質耐性株の出現を防ぐために組み合わせて使用されます。これは、多くの場合、添加剤ではなく、相乗効果をもたらします。相乗的は、2つの抗生物質の組み合わせ効果が個々の活動の合計よりも大きいことを意味する。しかし、この効果は、抗生物質の組み合わせのMIC値が少なくとも2倍減少した場合にのみ有意であると考えられる。この基準は、分数阻害濃度(FIC)インデックスを計算することによって評価されます。各抗生物質のMICのMICの比率を各抗生物質のMICと個別に組み合わせて合計することにより、0.5未満のFIC指数は相乗効果を示す。
抗生物質の相乗効果は、非クロス試験またはクロステストの2つのE検定ベースの方法を使用して測定することができる。非クロス試験では、まず、所定のMIC値を有する2つの異なる抗生物質のEストリップが2つの別々のプレートに適用される。抗生物質が培地に拡散した後、元のEストリップが除去され、代替抗生物質のEストリップが配置され、MICスケールが前のストリップのMICスケールの上に正確に置かれます。非クロステストのより速いバージョンであるクロステストでは、2つの抗生物質のEストリップが交差した形で一緒に配置され、そのMICマークのスケールが交点で90度の角度を形成します。両方の技術におけるインキュベーションに続いて、他の抗生物質と組み合わせた各抗生物質のMIC値は、成長阻害ゾーンがEストリップの縁と交差する点で読み取られます。次に、FIC インデックスが計算されます。
このビデオでは、E検定とマイクロブロス希釈試験を用いて、所定の細菌に対する特定の抗生物質のMIC値を決定する方法を示します。また、クロステストと非クロステストを使用して2つの抗生物質間の相乗効果を決定する方法を学びます。
まず、実験室用手袋やラボコートなど、適切な個人用保護具を着用してください。次に、70%エタノールを用いて作業スペースを殺菌する。次に、50%のライゼド馬の血液と20ミリリットルのβ-ニコチンアミドで無菌ミューラー・ヒントンのスープの15ミリリットルを収集します。そして、5〜8ミューラー・ヒントン寒天プレート。さて、マクファーランド濁度標準数0.5を調製するために、1%硫酸溶液の9.95ミリリットルを測定する。次に、硫酸溶液に1%塩化バリウム溶液の50マイクロリットルを添加する。溶液をよく渦にして濁液を得る。チューブをアルミホイルで覆い、脇に置きます。次に、15ミリリットルのチューブに生理食塩水の1ミリリットルを分配します。
滅菌ループを使用して、細菌試験プレートから細菌増殖のサンプルを掻き取り、ここでは、連鎖球菌群Gを使用します。その後、生理生理生理生理生理生理中に細菌を含んだループを入れ、穏やかにかき混ぜ、その後、チューブをよく渦にします。次に、細菌懸濁液とマクファーランド濁度基準を並べて配置し、濁り等価性を比較します。細菌懸濁液の濁りが標準の濁りと一致するまで、追加の生理塩分または細菌コロニーを追加します。所望の濁りが得られたら、無菌綿の先端アプリケーターを細菌の懸濁液に浸す。MH-Aプレートを接種するには、プレートの表面全体をジグザグモーションでそっと洗い、動かします。次に、プレートの底面に細菌の名前と日付をラベル付けします。
まず、ペニシリンG Eテストストリップを取り出し、鉗子で端に保持します。すり抜けたMH-Aプレートの中央にストリップをそっと置き、蓋を交換します。この例では、第2の抗生物質であるゲンタマイシンも試験される。これにより、ストリップ配置プロセスは、第2のプレートおよびゲンタマイシンE検定ストリップと共に繰り返される。E検定の結果を決定するには、ペニシリンG E検定ストリップを含む最初のプレートを収集します。次に、阻害ゾーンが抗生物質ストリップと交差する点を決定します。スケール上の対応する数値を読み取ります。この値は、ペニシリンG.のMIC値を同じ方法でゲンタマイシンのMIC値を決定する。
まず、ストレプトコッカス群G株細菌でMH-Aプレートを接種する。プレートの底部に細菌の名前、使用する抗生物質、および日付をラベル付けします。次に、関心のある抗生物質のE検定ストリップをプレートの中央に置きます。次に、2番目のテストストリップを最初のストリップに90度の角度で保持し、MICマークを見つけます。2 つの MIC 値が交差するポイントで、2 番目の E ストリップを最初の上にそっと置きます。ストリップを配置したら、それらを移動しないでください。次に、プレートを摂氏37度で18~20時間インキュベートします。
2つのMH-Aプレートを接種した後、連鎖球菌群G株細菌を用いて、1枚のプレートの表面に1つの抗生物質のE検定ストリップを置く。次に、示されるように、他の抗生物質用のE検定ストリップを第2のプレートに置く。プラスチック接種ループを使用して、それぞれのプレートの表面に各抗生物質のMIC値をマークします。次に、プレートを覆い、室温で1時間インキュベートします。この後、鉗子を使用してEストリップを取り外します。次に、プレートの1つと他の抗生物質のE検定ストリップを収集します。最初のストリップが残したインプリントの上にEテストストリップを保持し、EストリップのMIC値がマークされたラインに位置合わせするポイントを見つけます。この交差するポイントにストリップをそっと置き、配置します。2番目のプレートに対してこのプロセスを繰り返し、両方のプレートを摂氏37度で18~20時間インキュベートします。
まず、確立された細菌濃度を有する細菌懸濁液を得て、MHFブロスで培養を希釈して0.003のOD600を達成する。次に、ペニシリンGの16ミリグラムとゲンタマイシンの128ミリグラムを重量を量る。各計量乾燥抗生物質を215ミリリットルの円錐形チューブに移します。各円錐形のチューブに蒸留水の10ミリリットルを追加し、渦によってよく混合します。チューブに抗生物質の名前と濃度をラベル付けします。
三量体でアッセイを行い、96ウェルマイクロチタープレートの3列の最初のウェルに400マイクロリットルの作動細菌溶液を加える。次に、3列の井戸にMHFスープに働く細菌溶液の200マイクロリットルを追加します。さて、2倍の連続抗生物質希釈を生成するために、最初のウェルに4マイクロリットルの抗生物質ストックを加え、100倍の希釈を生成する。順次、200マイクロリットルの細菌系抗生物質溶液を各ウェルに移し、最初の井戸から2番目から2番目の行まで各行で十分に持続し、毎回の転写後に2〜3回ピペッティングして適切な混合を行う。細菌系抗生物質溶液の最終的な200マイクロリットルを廃棄します。
ペニシリンGのブロスマイクロ希釈試験の結果を決定するには、まず、濁りの欠如によって示される目に見える細菌増殖を示さないウェルを見つけます。これらの井戸から、最も低い抗生物質濃度で井戸を識別します。これは、試験された細菌に対するペニシリンGのMIC値を表す。ゲンタマイシンのMIC値は、同じアッセイおよび技術を用いて決定することができる。
非クロス試験の結果を決定するには、ペニシリンG Eストリップを含む最初のプレートを収集します。次いで、増殖抑制ゾーンが抗生物質ストリップと交差する点を決定する。スケール上の対応する値は、ゲンタマイシンと組み合わせたペニシリンGのMIC値を表す。この例では、組み合わせたMIC値は1ミリリットル当たり0.064マイクログラムです。
さて、ゲンタマイシンEストリップを含む第2のプレートを収集し、前に示したように組み合わせてMIC値を決定する。組み合わせの効果を評価するために、まず、抗生物質単独のMICでMICを組み合わせてMICを分割することにより、ペニシリンGに対する分画阻害濃度またはFICを算出する。ゲンタマイシンのこのプロセスを繰り返します。次に、ここに示す方程式を使用して FIC インデックスを計算します。組み合わせて MIC 値を 2 倍に減少すると、FIC インデックス値が 0.5 以下になり、ペニシリン G とゲンタマイシンの相乗効果が示されます。この場合、計算された FIC 値は 0.5 より大きい 1.18 です。したがって、結果は、ペニシリンGとゲンタマイシンとの間の連鎖球菌群G株に対する相乗効果を示さない。
クロステストの結果を決定するには、まず、成長阻害ゾーンがそれぞれのEストリップと交差する点を決定する。この交差点に対応する各 E 検定ストリップの数値を読み取ります。これらの値は、ペニシリンGとゲンタマイシンの組み合わせでMIC値を表す。次に、組み合わせの効果を評価するために、ここに示す式を用いてFIC指数を計算する。この例では、計算された FIC 値は 1.18 で、0.5 より大きくなります。これは、ペニシリンGおよびゲンタマイシンが連鎖球菌群G株に対して相乗的に作用しないことを意味する。
Subscription Required. Please recommend JoVE to your librarian.
Results
E検定におけるMIC値
個々のMIC値は、ペニシリンGの0.094 μg/mL、および8 μg/mLのゲンタマイシンとして図1で同定された。相乗効果試験では、ペニシリンGのMIC値を0.064 μg/mL(図2,3)、ゲンタマイシンはクロス試験と非クロス試験に対してMIC4 μg/mLを示しました。クロステストと非クロステストの間にわずかな不一致が生じる場合は、2 つの設定でストリップのインキュベーション時間が異なる場合があります。
相乗効果の計算
FIC の方程式は次のとおりです。
 = 1.18 >0.5 (相乗効果なし)
= 1.18 >0.5 (相乗効果なし)
スープ中のMIC判定
井戸の曇りは細菌の増殖を示し、したがって阻害は起こらなかった。ペニシリンG(図4)で最初のクリアウェルは0.12 μg/mLペニシリンGを含んでいたので、これはMIC値でした。ゲンタマイシンについては、最初のクリアウェルは8 μg/mLゲンタマイシンに存在していた。ペニシリンG値は、ストリップの高い解像度(例えば、2倍の因子ではなく、1.5倍の連続希釈に基づく)のために、E検定を使用する場合よりもわずかに高かった。
接種サイズ
接種サイズを決定するために、図5および6に概説するアプローチが用いられた。コロニーはD行(1000x希釈)でカウントされ、平均値が7.67 cfuの三重系列で最大7、8、および8を加算した。希釈係数(例えば1000倍)を乗算するコロニーの数は、cfu/mLを得るために100と同様に、約8 x 105の接種サイズを与え、105-6 cfu/mLの標的接種サイズ内に十分に与える。
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
抗生物質耐性は世界的な健康問題です。微生物の耐性機構を決定するためには、異なる抗生物質との相乗効果と拮抗作用をテストする方法が重要です。E検定法は、迅速かつ複製が容易であり、併用療法の相乗的な可能性を調査するために使用することができます。ブロス希釈法は、殺菌活性を予測するために評価することもできる。異なる微生物の耐性メカニズムを調べるためには、相乗的および拮抗的な抗生物質相互作用の知識が重要である。抗生物質を組み合わせることは、治療効果を高め、抗生物質耐性に直面する戦略でありうみがあります。ここで行った試験では、グループG連鎖球菌に対するペニシリンGおよびゲンタマイシンのMIC値を決定することができた。我々はまた、2つの抗生物質が相乗効果を示さないことを実証し、したがって、そのような感染症に対する好ましい治療選択肢ではないであろう。
Subscription Required. Please recommend JoVE to your librarian.
References
- Tan SY, Tatsumura Y. Alexander Fleming (1881-1955): Discoverer of penicillin. Singapore Medical Journal. 56 (7):366-7. (2015)
- Aminov RI. A brief history of the antibiotic era: lessons learned and challenges for the future. Frontiers in Microbiology. 1:134. (2010)
- Pankey GA, Ashcraft DS, Dornelles A. Comparison of 3 E-test (®) methods and time-kill assay for determination of antimicrobial synergy against carbapenemase-producing Klebsiella species. Diagnostic Microbiology and Infectious Disease. 77 (3):220-6. (2013)
- EUCAST: European Committee On Antimicrobial Susceptibility Testing (www.eucast.org).
- Wiegand I, Hilpert K, Hancock RE. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nature Protocols. 3 (2):163-75. (2008)
- Doern CD, When does 2 plus 2 equal 5? A review of antimicrobial synergy testing. Journal of Clinical Microbiology. 52 (12):4124-28. (2014)
- Worthington RJ, Melander C. Combination approaches to combat multi-drug resistant bacteria. Trends in Biotechnology. 31 (3):177-84. (2013)




