3.8: Conceitos de Massa Molar e Moles de Compostos
Massa Molar de Compostos Covalentes
As fórmulas químicas representam a composição elementar das substâncias. Para os compostos covalentes, a fórmula representa os números e tipos de átomos que compõem uma única molécula da substância; assim, a massa molar pode ser correctamente referida como massa molecular. A massa molecular do clorofórmio (CHCl3), um composto covalente, indica que uma única molécula contém um átomo de carbono, um átomo de hidrogénio, e três átomos de cloro. A massa molecular média de uma molécula de clorofórmio é igual à soma das massas atómicas médias destes átomos:
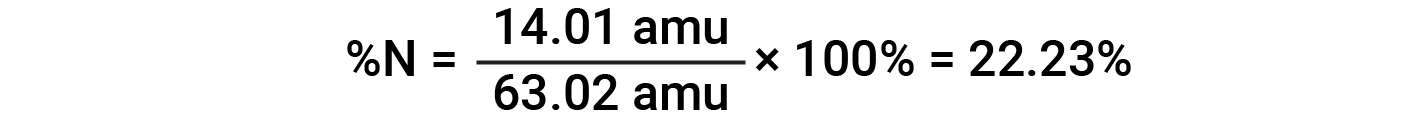
Massa Molar de Compostos Iónicos
Os compostos iónicos são compostos por catiões e aniões discretos que são combinados em relações de forma a produzir massa volumosa eletricamente neutra. A massa molar para um composto iónico é calculada da mesma forma que a massa molar para compostos covalentes: somando as massas atómicas médias de todos os átomos na fórmula do composto. No entanto, a fórmula de um composto iónico não representa a composição de uma molécula discreta, portanto pode não ser corretamente referida como ‘massa molecular’.
Por exemplo, o sal de mesa comum ou cloreto de sódio (NaCl) é um composto iónico composto por catiões de sódio (Na+) e aniões cloreto (Cl−) combinados em uma razão de 1:1. A massa molar para este composto é calculada adicionando as massas atómicas médias dos seus elementos constitutivos:
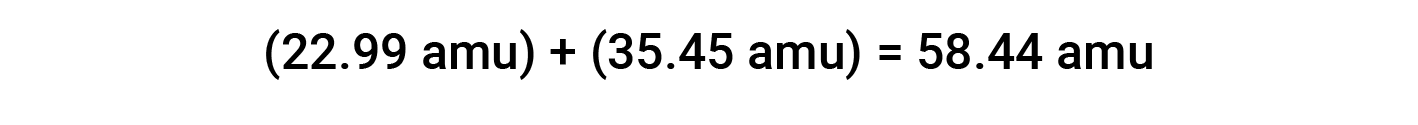
Ao computar a massa molar de um composto iónico, são utilizadas as massas médias de átomos neutros de sódio e cloro, em vez das massas para catiões de sódio e aniões cloreto. Mesmo que um catião de sódio tenha uma massa ligeiramente menor do que um átomo de sódio (uma vez que está a faltar um eletrão), esta diferença será compensada pelo facto de que um anião cloreto é ligeiramente mais pesado do que um átomo de cloro (devido ao eletrão extra). Além disso, a massa de um eletrão é pequena, de forma desprezível, em relação à massa de um átomo típico.
Composição Percentual de Massa
A composição elementar de um composto define a sua identidade química, e as fórmulas químicas são a maneira mais concisa de representar esta composição elementar. A percentagem de massa de cada elemento no composto é chamada de percentagem de massa desse elemento específico. A composição percentual pode ser calculada dividindo a massa de cada elemento pela massa total do composto e, em seguida, converter para uma percentagem.
A composição percentual é útil para avaliar a abundância relativa de um determinado elemento em diferentes compostos de fórmulas conhecidas. Desde que a fórmula molecular ou empírica do composto em questão seja conhecida, a composição percentual pode ser derivada das massas atómicas ou molares dos elementos do composto.
Por exemplo, uma molécula de ácido nítrico (HNO3) contém um átomo de azoto pesando 14,01 amu, um átomo de hidrogénio pesando 1,008 amu, e três átomos de oxigénio pesando (3 × 16,00 amu) = 48,00 amu. A massa molar do ácido nítrico é, portanto (14,01 amu + 1,008 amu + 48,00 amu) = 63,02 amu, e sua composição percentual é:
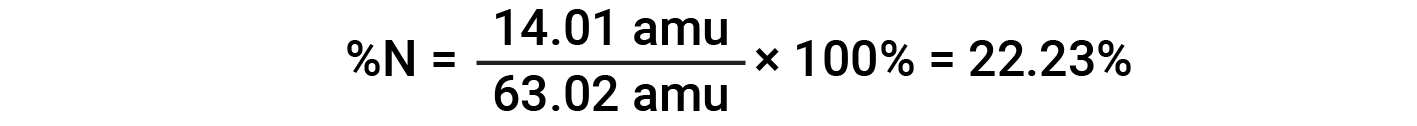
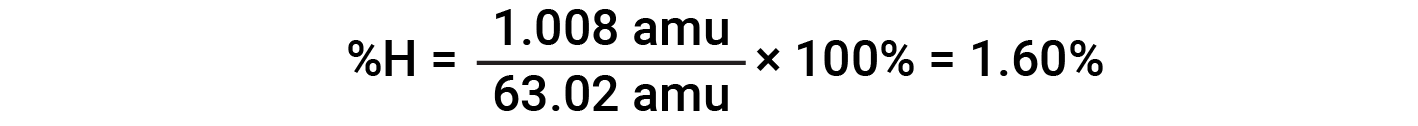
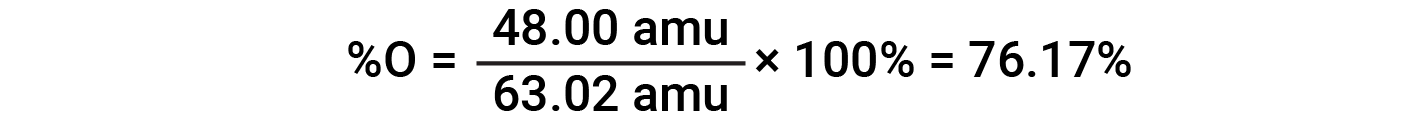
Este texto é adaptado de Openstax, Chemistry 2e, Section 3.1: Formula Mass and the Mole Concept e Openstax, Chemistry 2e, Section 3.2: Determining Empirical and Molecular Formulas.


