3.9: Экспериментальное определение химической формулы
Элементный состав вещества определяет его химическую идентичность, а химические формулы являются наиболее точным способом представления этого элементного состава. Когда формула вещества неизвестна, измерение массы его составных элементов часто является первым шагом в экспериментальном определении формулы.
Определение эмпирических формул
Наиболее распространенный подход к определению химической формулы вещества заключается в том, чтобы сначала измерить массы составляющих его элементов. Однако химические формулы представляют собой относительные числа, а не массы атомов в веществе. Поэтому для получения соответствующих чисел атомов в составе соединения необходимо использовать любые экспериментально полученные данные, связанные с массой. Это достигается с помощью молярных масс для преобразования массы каждого элемента в количество молей. Количества молей используются для вычисления целых чисел, которые могут быть утилизированы для вычисления эмпирической формулы вещества.
Рассмотрим образец соединения, содержащего 1.71 грамма углерода и 0.287 грамма водорода. Соответствующие числа атомов — 0.142 моля углерода и 0.284 моля водорода. Таким образом, это соединение может быть представлено формулой C0.142H0.284. В соответствии с условными формулами используются целые числа подстрочных индексов, которые можно получить, разделив каждый подстрочный индекс на наименьший индекс (0.142). Таким образом, эмпирическая формула для этого соединения CH2. Подстроки “1” не написаны, а скорее предположены, если нет другого числа. Это может быть или не быть молекулярной формулой соединения; однако для этого требуется дополнительная информация.
В качестве второго примера можно привести образец соединения, содержащий 5.31 грамма хлора и 8.40 грамма кислорода. Такой же подход дает предварительную эмпирическую формулу ClO3.5. В этом случае деление на наименьший индекс все еще оставляет десятичный знак в эмпирической формуле. Чтобы преобразовать это в целое число, умножьте каждый индекс на два, сохранив тот же коэффициент атома и уступая Cl2О7 конечной эмпирической формуле.
Получение эмпирических формул из процентного состава
В случаях, когда доступен процентный состав вещества, он используется для расчета массы элементов, присутствующих в составе вещества. Так как шкала процентов составляет 100, удобно рассчитать массу элементов, присутствующих в образце весом 100 грамм. Полученные массы используются для получения эмпирической формулы.
Например, предположим, что газообразное соединение содержит 27.29% C и 72.71% O. таким образом, процентное содержание массы выражается в виде фракций:
Масса углерода, 27.29 грамма, соответствует 2.272 моля углерода, а масса кислорода, 72.71 грамма, соответствует 4.544 моля кислорода. Поэтому репрезентативной формулой является C2.272О4.544. Разделение каждого подстрочного индекса на 2.272 дает эмпирическую формулу: CO2.
Создание молекулярных формул
Определение абсолютных чисел атомов, составляющих одну молекулу ковалентного соединения, требует знания как его эмпирической формулы, так и его молекулярной массы или молярной массы. Эти количества могут быть определены экспериментально различными методами измерения. Молекулярная масса, например, часто выводится из масс-спектра соединения.
Молекулярные формулы получены путем сравнения молярной массы или молекулярной массы соединения с его эмпирической массой формулы. Как следует из названия, масса эмпирической формулы — это сумма средних атомных масс всех атомов, представленных в эмпирической формуле. Если известная молярная масса вещества делится на массу эмпирической формулы, то она дает количество единиц эмпирической формулы на молекулу (n).
Затем молекулярная формула получается путем умножения каждого индекса в эмпирической формуле на n, как показано на общей эмпирической формуле AxBy:
Например, эмпирическая формула ковалентного соединения определена как CH2O, а его эмпирическая формула массы составляет приблизительно 30 amu. Если молекулярная масса соединения определяется как 180 amu, это означает, что молекулы этого соединения содержат в шесть раз больше атомов, представленных в эмпирической формуле.
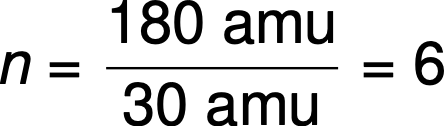
Молекулы этого соединения затем представлены молекулярной формулой с подстроками, которые в шесть раз больше, чем в эмпирической формуле: (CH2)6 = C6Н12О6.
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 3.2: Определение эмпирических и молекулярных формул.


