4.8: 水溶液中的化学反应
化学物质以许多不同的方式相互作用。某些化学反应表现出常见的反应模式。由于化学反应的数量众多,因此有必要根据观察到的相互作用模式对它们进行分类。
水是一种很好的溶剂,可以溶解许多物质。因此,许多化学反应在水中发生。这种反应称为水相反应。三种最常见的水反应类型是沉淀,酸碱和氧化还原。
水溶液中的反应
沉淀反应涉及水溶液中离子化合物之间的离子交换,形成不溶性盐或沉淀。在酸碱反应中,酸与碱反应,两者相互中和,生成盐和水。氧化还原反应涉及反应物种之间电子的转移。失去电子的反应物被称为被氧化,获得电子的反应物被称为被还原。
水性反应方程式
当涉及离子时,有多种方法可以表示在水性介质中发生的反应,每种方法具有不同的详细程度。为了理解这一点,让我们以沉淀反应为例。反应发生在离子化合物的水溶液之间,例如BaCl 2 和AgNO 3 。反应产物是Ba(NO 3 ) 2 水溶液和固体AgCl。
该平衡方程称为分子方程。分子方程式提供化学计量信息以进行定量计算,还有助于识别所使用的试剂和形成的产物。但是,分子方程式没有提供溶液中反应过程的详细信息。也就是说,它并不表示溶液中存在的不同离子种类。
离子化合物如BaCl 2 ,AgNO 3 和Ba(NO 3 ) 2 都是水溶性的。它们通过解离成其组成离子而溶解,并且它们的离子均匀地分散在溶液中。
由于AgCl是不溶性盐,它不会解离成离子,而是以固体形式保留在溶液中。考虑到以上因素,该反应的更现实表示为: 
这是一个完整的离子方程,其中所有溶解的离子都得到了明确表示。  
此完整的离子方程式表示两个化学形式相同的两面,分别是Ba 2 + ( aq )和NO 3 < / sub> &minus;&nbsp; ( aq )。这些被称为旁观者离子。这些离子的存在是维持电荷中性所必需的。由于它们既不会在化学上也不会在物理上发生变化,因此可以从方程式中消除它们。
此等式可以进一步简化为:
这是净离子方程。这表明,不管这些离子的来源如何,都可能由溶解的氯离子和银离子产生固态氯化银。 &nbsp;
本文改编自 OpenStax 化学2e ,第4.1节:编写和平衡化学方程式。




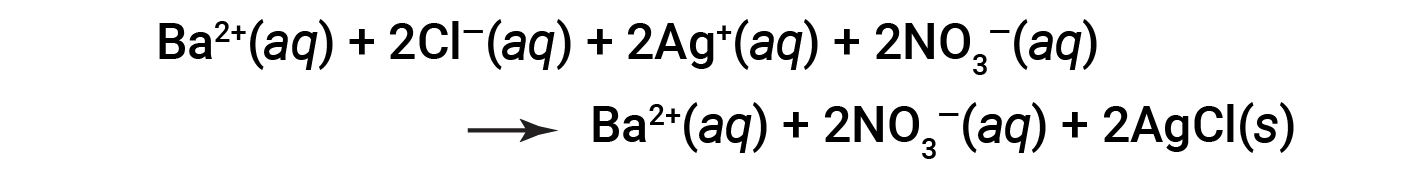

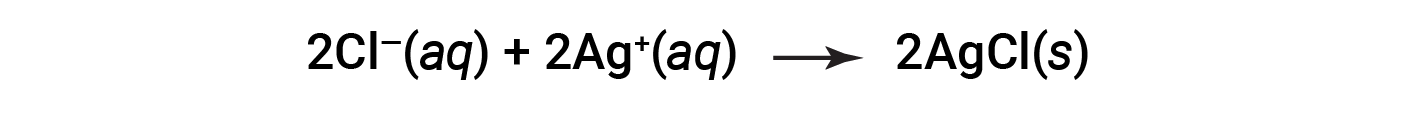
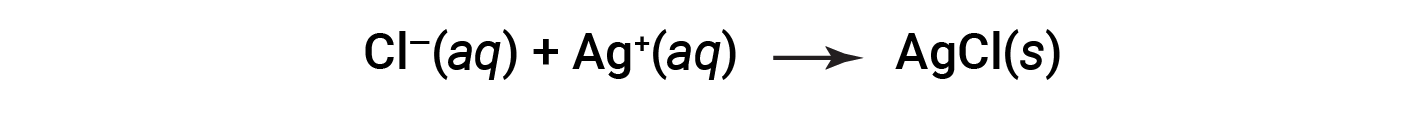
Tags
Chemical Reactions
Aqueous Solutions
Precipitation Reaction
Acid-base Reaction
Oxidation-reduction Reaction
Insoluble Ionic Compound
Proton
Hydroxide Ion
Water
Salt
Redox Reaction
Electrons Transfer
Dissolved Substance
Lead (I)


