5.10: Gases Reais - Desvio da Lei do Gás Ideal
Até agora, a lei de gás ideal, PV = nRT, tem sido aplicada a uma variedade de diferentes tipos de problemas, desde a estequiometria de reação e problemas de fórmula empírica e molecular até à determinação da densidade e massa molar de um gás. No entanto, o comportamento de um gás é muitas vezes não-ideal, o que significa que as relações observadas entre a sua pressão, volume, e temperatura não são descritas com precisão pelas leis dos gases.
De acordo com a teoria cinética molecular, as partículas de um gás ideal não apresentam forças de atração ou repulsão umas sobre as outras. Presume-se que têm um volume insignificante em comparação com o do recipiente. À temperatura ambiente e a 1 atm ou menos, os gases seguem o comportamento ideal, como implícito na equação de gás ideal.
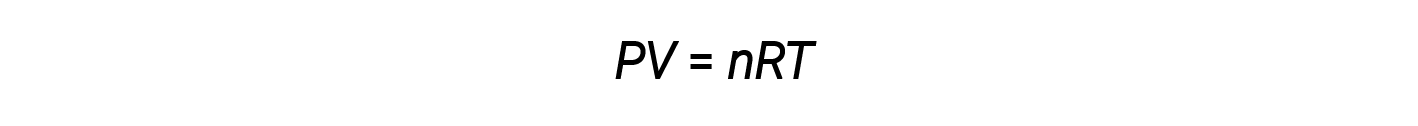
A pressões mais altas ou temperaturas mais baixas, no entanto, ocorrem desvios da lei de gás ideal, o que significa que as relações observadas entre a sua pressão, volume, e temperatura não são seguidas com precisão.
Reorganizando a equação de gás ideal para resolver para n obtemos:
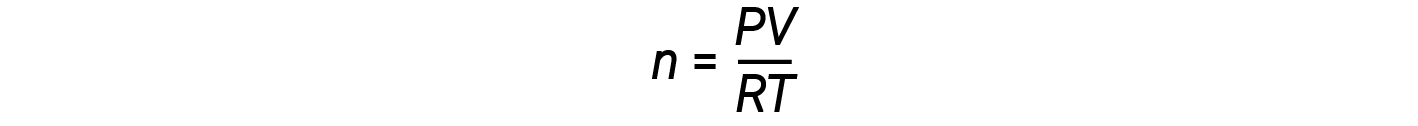
Para 1 mole de um gás ideal, a relação PV/RT = 1, independentemente da pressão. Qualquer desvio desta relação de um é uma indicação de comportamento não ideal.
A lei de gás ideal não descreve bem o comportamento do gás a pressões relativamente elevadas. Ou seja, a relação é igual a 1 apenas a pressões baixas. Mas à medida que a pressão aumenta, PV/RT começa a desviar-se de 1 e os desvios não são uniformes. A altas pressões, o desvio do comportamento ideal é grande e diferente para cada gás. Por outras palavras, os gases reais não se comportam idealmente a alta pressão. A pressões mais baixas (geralmente abaixo de 10 atm), no entanto, o desvio do comportamento ideal é pequeno, e podemos usar a equação de gás ideal.
As partículas de um gás ideal hipotético não têm volume significativo e não se atraem nem repelem umas às outras. No geral, os gases reais aproximam-se deste comportamento a pressões relativamente baixas e temperaturas elevadas. No entanto, a altas pressões, as moléculas de um gás estão mais próximas umas das outras e a quantidade de espaço vazio entre as moléculas é reduzida. A estas pressões mais elevadas, o volume das próprias moléculas de gás torna-se apreciável em relação ao volume total ocupado pelo gás. O gás, portanto, torna-se menos compressível a essas altas pressões, e embora o seu volume continue a diminuir com o aumento da pressão, essa diminuição não é proporcional como previsto pela lei de Boyle.
A pressões relativamente baixas, as moléculas de gás não têm praticamente nenhuma atração umas pelas outras porque estão (em média) muito afastadas, e comportam-se quase como partículas de um gás ideal. No entanto, a pressões mais elevadas, a força de atração já não é insignificante. Esta força aproxima as moléculas um pouco mais, diminuindo ligeiramente a pressão (se o volume for constante) ou diminuindo o volume (a pressão constante). Esta alteração é mais pronunciada a baixas temperaturas porque as moléculas têm KE mais baixa relativamente às forças de atração, e são portanto menos eficazes em superar estas atrações após colidirem umas com as outras.
Existem várias equações diferentes que se aproximado melhor do comportamento dos gases do que a lei de gás ideal. A primeira, e mais simples, foi desenvolvida pelo cientista Holandês Johannes van der Waals em 1879. A equação de van der Waals melhora a lei de gás ideal adicionando dois termos: um para contabilizar o volume das moléculas de gás e outro para as forças de atração entre elas.
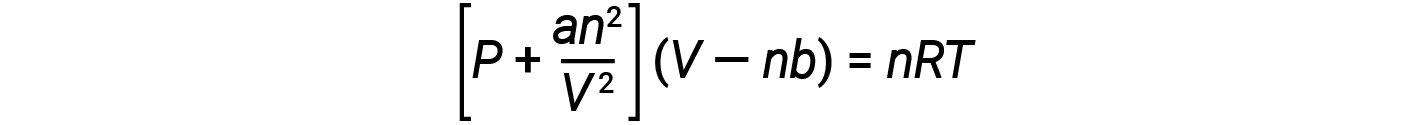
A constante a corresponde à força da atração entre moléculas de um gás particular, e a constante b corresponde ao tamanho das moléculas de um gás particular. A “correção” do termo da pressão na lei de gás ideal é an2/V2 e a “correção” do volume é nb. Observe que quando V é relativamente grande e n é relativamente pequeno, ambos os termos de correção se tornam desprezíveis, e a equação van der Waals reduz-se à lei de gás ideal, PV = nRT. Tal condição corresponde a um gás no qual um número relativamente baixo de moléculas ocupa um volume relativamente grande, ou seja, um gás a uma pressão relativamente baixa.
A baixas pressões, a correção da atração intermolecular, a, é mais importante do que a correção do volume molecular, b. A altas pressões e pequenos volumes, a correção do volume das moléculas torna-se importante porque as próprias moléculas são incompressíveis e constituem uma fração apreciável do volume total. Em alguma pressão intermediária, as duas correções têm influências opostas, e o gás parece seguir a relação dada por PV = nRT sobre uma pequena gama de pressões.
Estritamente falando, a equação de gás ideal funciona bem quando as atrações intermoleculares entre moléculas de gás são negligenciáveis, e as moléculas de gás em si não ocupam uma parte apreciável do volume total. Estes critérios são satisfeitos em condições de baixa pressão e alta temperatura. Em tais condições, diz-se que o gás se comporta idealmente, e os desvios das leis dos gases são suficientemente pequenos para que possam ser ignorados — no entanto, isto muitas vezes não é o caso.
Este texto é adaptado de Openstax, Chemistry 2e, Section 9.2: Non-ideal Gas Behavior.


