9.5: 晶格能量的趋势:离子大小和电荷
离子化合物由于其正离子和负离子之间的静电吸引而稳定。化合物的晶格能量是该吸引力强度的量度。离子化合物的晶格能量(Δ H lattice )定义为将一摩尔固体分离成其气态离子所需的能量。对于离子型固体氯化钠,晶格能是过程的焓变: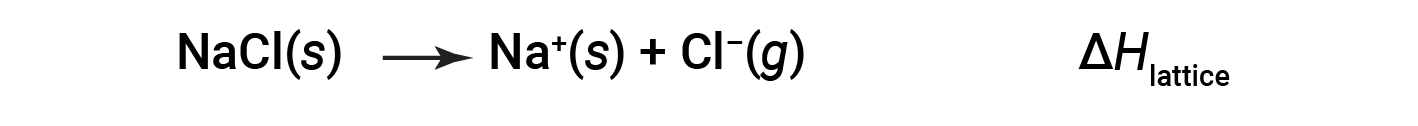
公约
在这里,使用约定将离子固体分离为离子,这意味着晶格能量将是吸热的(正值)。另一种方法是使用等效但相反的约定,其中晶格能量是放热的(负值),并且被描述为当离子结合形成晶格时释放的能量。因此,请确保在另一个参考文献中查找晶格能量时确认使用哪个定义。在这两种情况下,较大的晶格能量表明离子化合物更稳定。对于氯化钠,Δ H 晶格 = 769 kJ。因此,将一摩尔固体NaCl分离成气态Na + 和Cl n 离子需要769 kJ。当气态Na + 和Cl n 离子每摩尔形成固体NaCl时,会释放769 kJ热量。
晶格能量< H 晶格可以用以下公式表示(从库仑定律推导,决定电荷之间的力) :
ΔHlattice = C(Z +)(Z−)/Ro ,其中 C 是一个常数,取决于晶体结构的类型; Z + 和 Z – 是离子上的电荷,而 R o 是离子间距(正离子和负离子的半径之和)。因此,离子晶体的晶格能量随着离子电荷的增加和离子尺寸的减小而迅速增加。当所有其他参数保持恒定时,将阳离子和阴离子的电荷加倍会使晶格能翻两番。
此文本改编自 Openstax ,化学2e,第7.5节:离子键和共价键的强度。
库仑定律和晶格能量
离子晶体的
示例
Tags
Lattice Energy
Ion Size
Charge
Ionic Compound
Coulomb's Law
Potential Energy
Distance Between Ions
Bond Length
Alkali Metals
Alkaline Earth Metals
Internuclear Distance
Attraction Between Ions
Lattice Energy Magnitude


