10.1: 价层电子对互斥理论(VSEPR) 和基本形状
价层电子对互斥理论(VSEPR) 概述
价壳层电子对互斥理论 (价层电子对互斥理论(VSEPR)) 使我们能够通过检查路易斯结构中的键和单电子对数来预测分子的分子结构,包括围绕中心原子的近似键角度。 价层电子对互斥理论(VSEPR) 模型假设中央原子的价壳层中的电子对将采用一种排列方式,通过最大化电子对之间的距离来最大程度地减少电子对之间的脉冲。 中央原子的价壳层中的电子形成主要位于键合原子或孤对之间的键对电子。 当高电子密度的不同区域假设位置尽可能彼此间距离时,这些电子的静电互斥会降低。
价层电子对互斥理论(VSEPR) 预测每个中心原子周围的电子对排列,通常是分子中原子的正确排列。 但是,我们应该理解,理论只考虑电子对脉冲。 其他相互作用,如核核粉碎和核电子景点,也涉及原子在特定分子结构中采用的最终安排。
价层电子对互斥理论(VSEPR) 的应用
价层电子对互斥理论(VSEPR) 可用于预测分子的结构。 例如,让我们预测气态二氧化碳分子的结构。 二氧化碳的路易斯结构 (图 1) 仅显示围绕中央碳原子的两个电子组。 由于中央原子上有两个键组且没有孤对电子,键尽可能地分离,当这些高电子密度区域位于中央原子的另一侧时,它们之间的静电互斥将降至最低。 键角度为 180°。
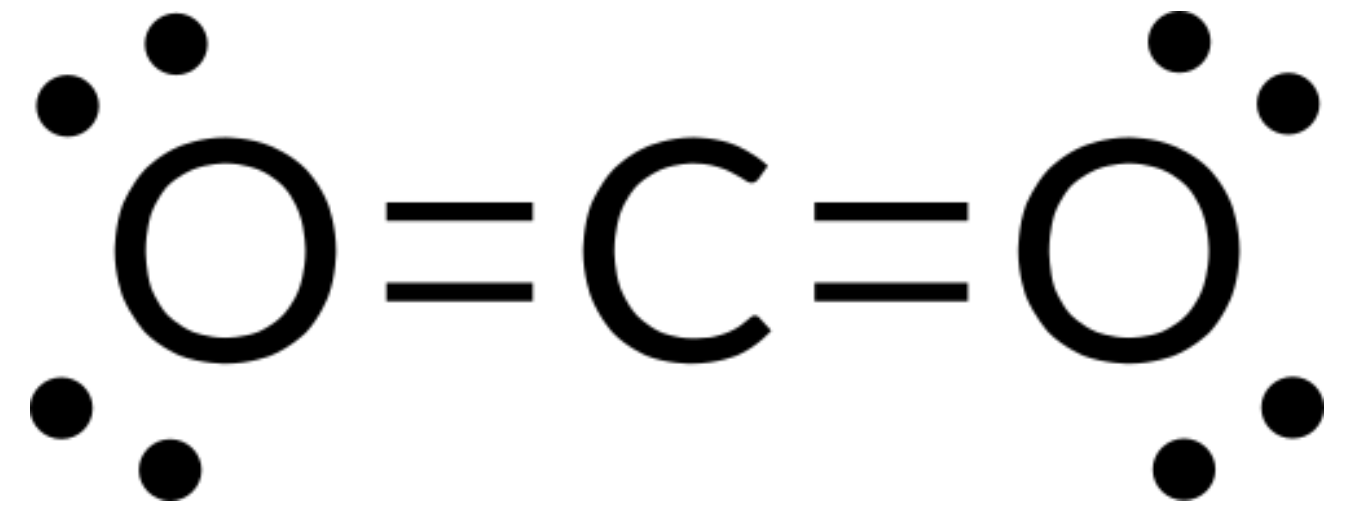
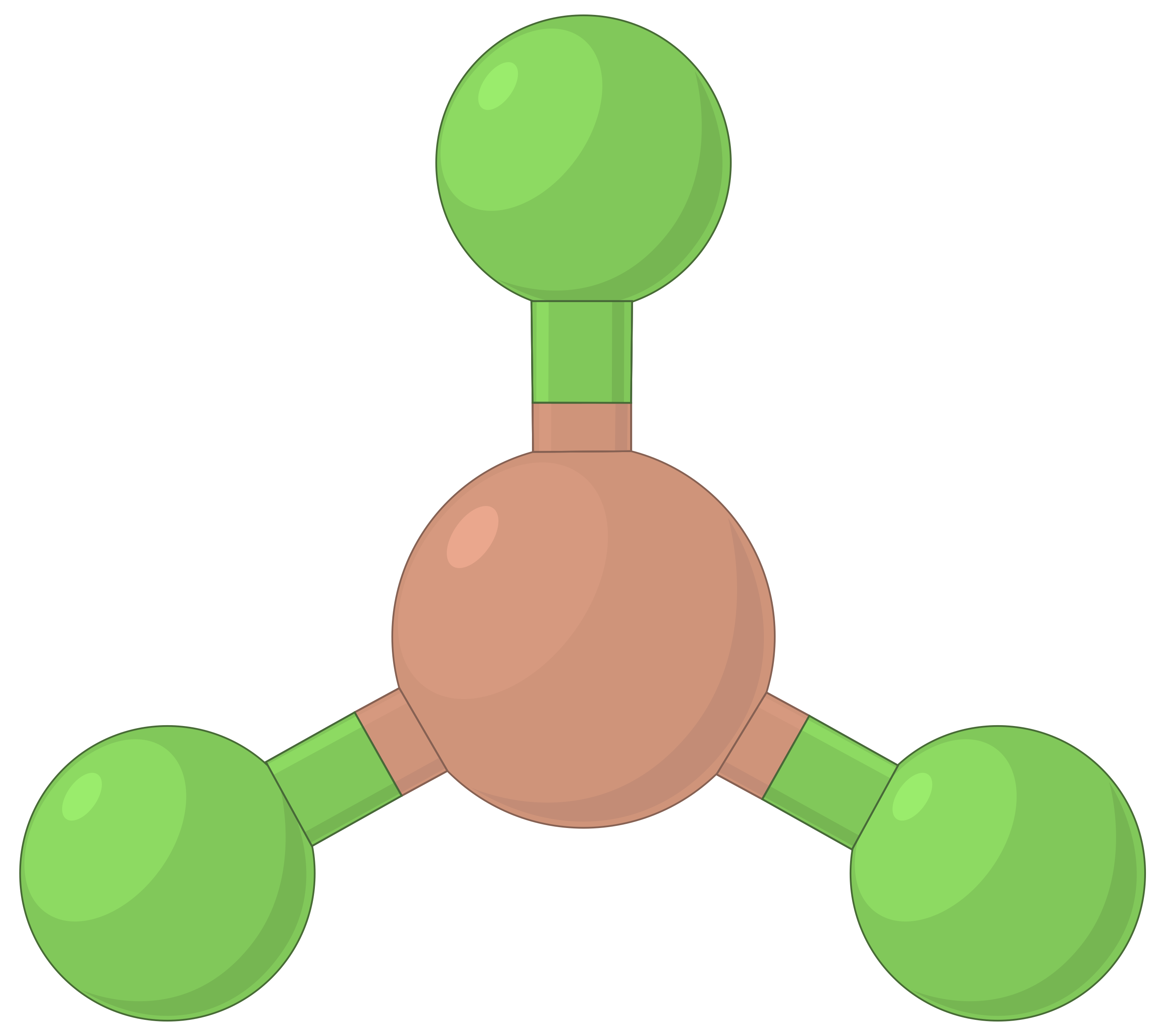
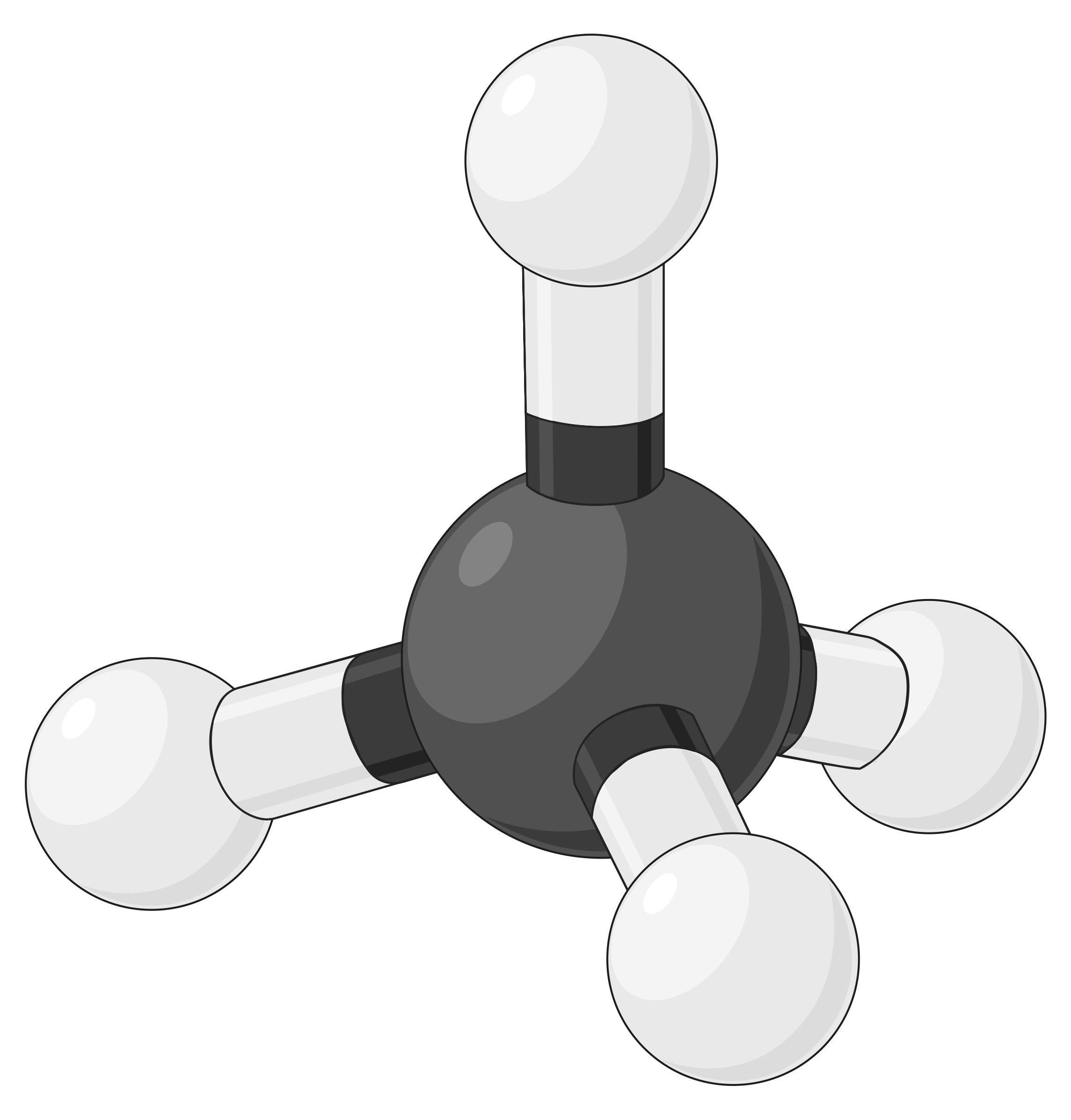
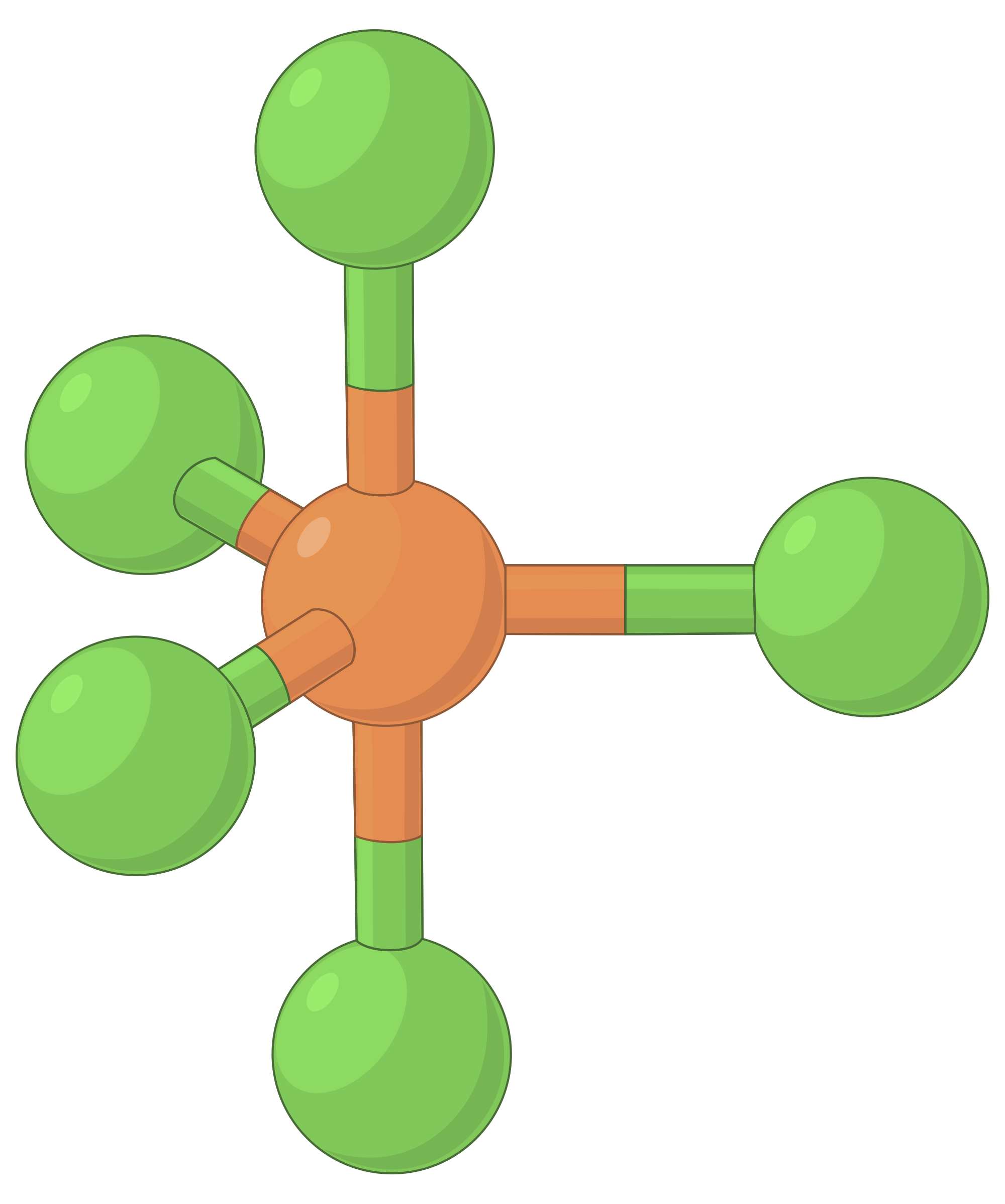
下表说明了电子对几何形状,这些几何形状可以最大程度地减少高电子密度区域 (键和 / 或孤对) 之间的脉冲。 分子中一个中心原子周围的两个电子密度区域形成线性几何体;三个区域形成三角平面几何体;四个区域形成四面几何体;五个区域形成三角斜向几何体,六个区域形成八面体几何体。
| 错误 2 | BF3 | 甲烷 | PCL5 | SF6 | |
| 电子区域数 | 2.3. | 4. | 5. | 6. | |
| 电子区域几何体 | 线性; 180° 角 | 三角平面;所有角度为 120° | 四面;所有角度 109.5° | 三角双相,角度为 90° 或 120°。 | 八面体;所有角度 90° 或 180°。 |
| 空间安排 | 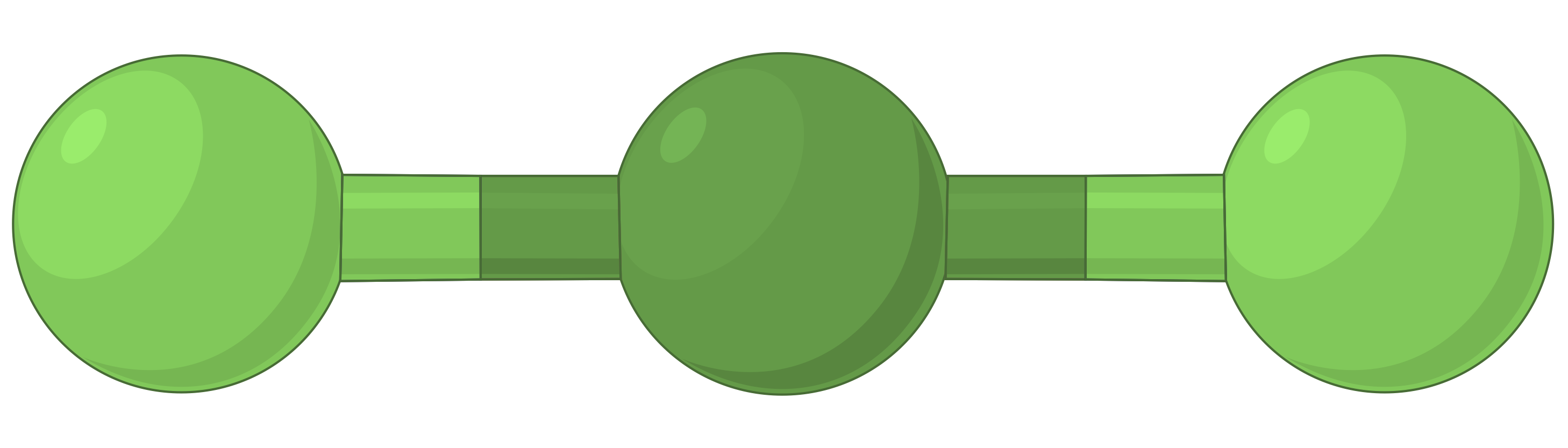 |
 |
 |
 |
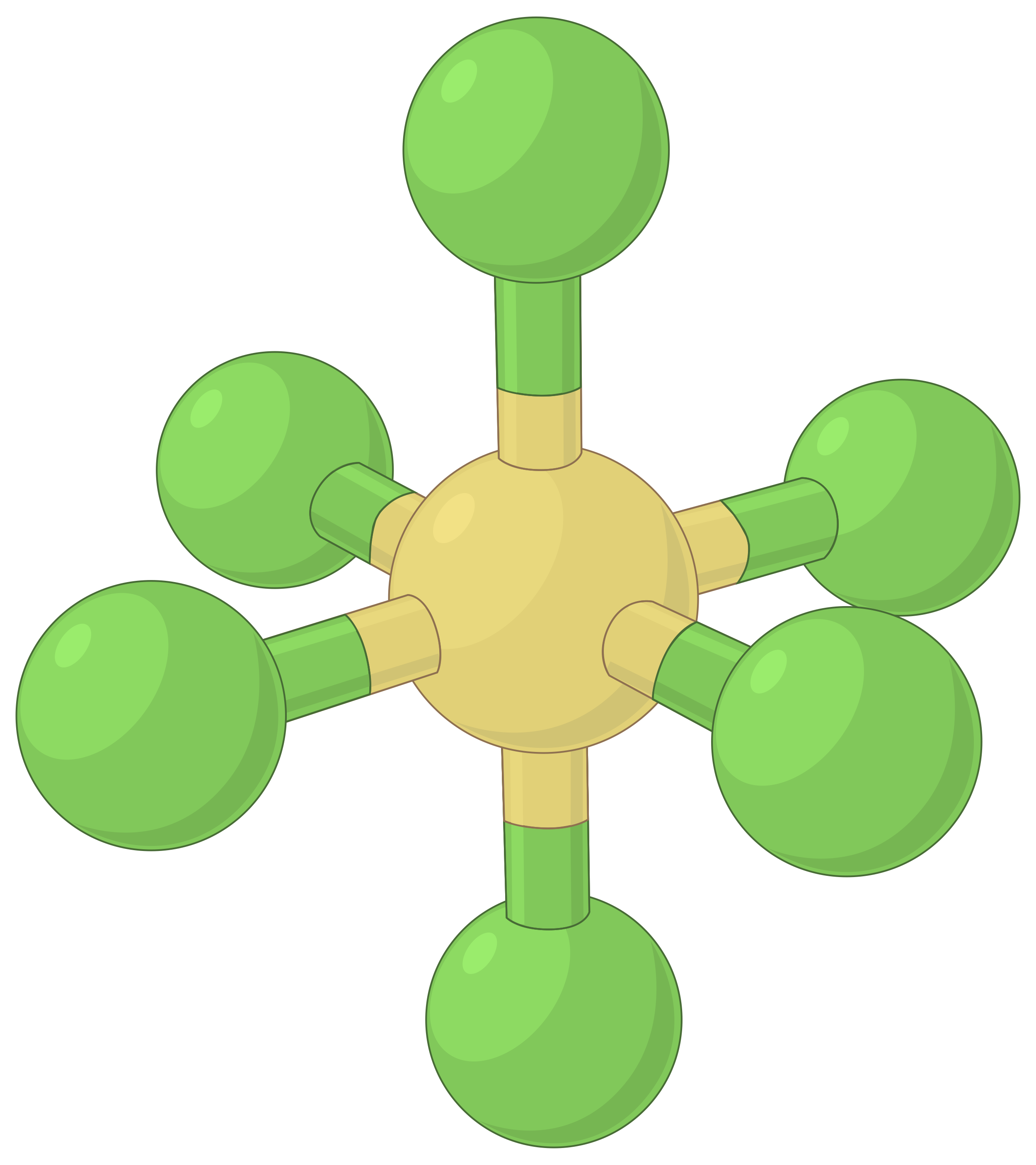 |
表 1. 价层电子对互斥理论(VSEPR) 预测的基本电子对几何形状可最大化电子密度任何区域 (键或孤对) 周围的空间。
本文改编自 Openstax, 化学 2e, 第7.6节:分子结构与极性。


