11.7: Changement d'état : vaporisation et condensation
La forme physique d'une substance change lorsque sa température change. Par exemple, l'élévation de la température d'un liquide provoque la vaporisation du liquide (transformation en vapeur). Ce processus est appelé vaporisation, un phénomène de surface. La vaporisation se produit lorsque le mouvement thermique des molécules dépasse les forces intermoléculaires et que les molécules (à la surface) passent à l'état gazeux. Lorsqu'un liquide se vaporise dans un récipient fermé, les molécules de gaz ne peuvent pas s'échapper. Comme ces molécules en phase gazeuse se déplacent de façon aléatoire, elles peuvent parfois entrer en collision avec la surface de la phase condensée, et dans certains cas, ces collisions entraînent le retour des molécules dans la phase condensée. Le passage de la phase gazeuse au liquide est appelé condensation.
La vaporisation est un processus endothermique. L'effet de refroidissement est évident après une baignade ou une douche. Lorsque l'eau sur la peau s'évapore, elle enlève de la chaleur à la peau et refroidit la peau. La variation d'énergie associée au processus de vaporisation est l'enthalpie de vaporisation, ΔHvap. Par exemple, la vaporisation de l'eau à la température standard est représentée par :

L'inverse d'un processus endothermique est exothermique. Ainsi, la condensation d'un gaz dégage de la chaleur :
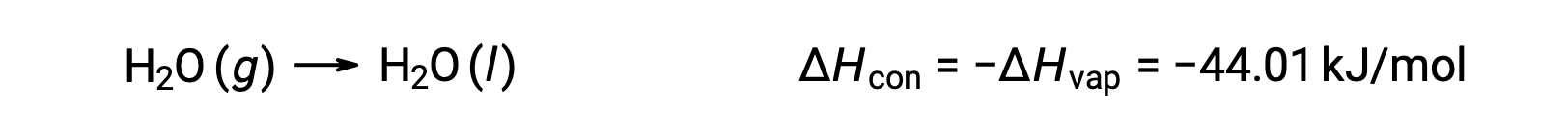
La vaporisation et la condensation sont des processus opposés ; par conséquent, les valeurs de leur enthalpie sont identiques avec des signes opposés. Alors que l'enthalpie de vaporisation est positive, l'enthalpie de condensation est négative.
Différentes substances se vaporisent à des degrés différents (en fonction de la force de leurs Fim) et elles présentent donc des valeurs différentes de l'enthalpie de vaporisation. Des forces intermoléculaires attractives relativement intenses entre les molécules entraînent des valeurs plus élevées de l'enthalpie de vaporisation. Les attractions intermoléculaires faibles présentent moins de barrière à la vaporisation, ce qui donne des valeurs relativement faibles d'enthalpies de vaporisation.
Ce texte est adapté de Openstax, Chimie 2e, Section 10.3 : Transitions de phases.


