11.11: 相転移:昇華と凝結
固体の中には、昇華と呼ばれる過程を経て、液体を経由せずに直接気体になるものがあります。室温・標準圧力下では、ドライアイス(固体のCO2)が昇華し、液体になることなく徐々に消えていくように見えます。雪や氷は、水の融点以下の温度でゆっくりと昇華していくが、高地では風や気圧の低下によって促進されることもあります。固体のヨウ素を温めると、固体が昇華して鮮やかな紫色の蒸気が発生します。昇華の逆は凝結と呼ばれ、気体が液体を経ずに直接固体に凝縮する過程です。霜がつくのも凝結の一例です。
気化と同様に、昇華のプロセスには、分子間引力を克服するためのエネルギーの投入が必要です。したがって、昇華は吸熱性の相転移です。昇華のエンタルピーである ΔH は、1モルの物質を固体から気体にするのに必要なエネルギーです。例えば、二酸化炭素の昇華は次のように表されます。

同様に、逆のプロセスである凝結のエンタルピー変化は、昇華のそれと大きさは同じだが符号が逆です。凝結は分子間力の形成を伴うため、発熱性の相転移となります。

ある相転移を達成するために、分子間引力をどの程度克服しなければならないかを考えてみましょう。固体から液体への相転移では分子間引力を部分的にしか克服できず、気体への相転移では分子間引力を完全に克服しなければなりません。その結果、物質の融解エンタルピーは気化エンタルピーよりも小さくなります。これと同じ理屈で、ある物質のすべての相変化のエンタルピーの近似関係を導き出すことができます。完全に正確な表現ではないが、ヘスの法則を適用するためには、昇華は融解と気化の2段階のプロセスとしてモデル化するのが便利です。このように考えると、ある物質の昇華エンタルピーは、融解エンタルピーと気化エンタルピーの合計として見積もることができます。
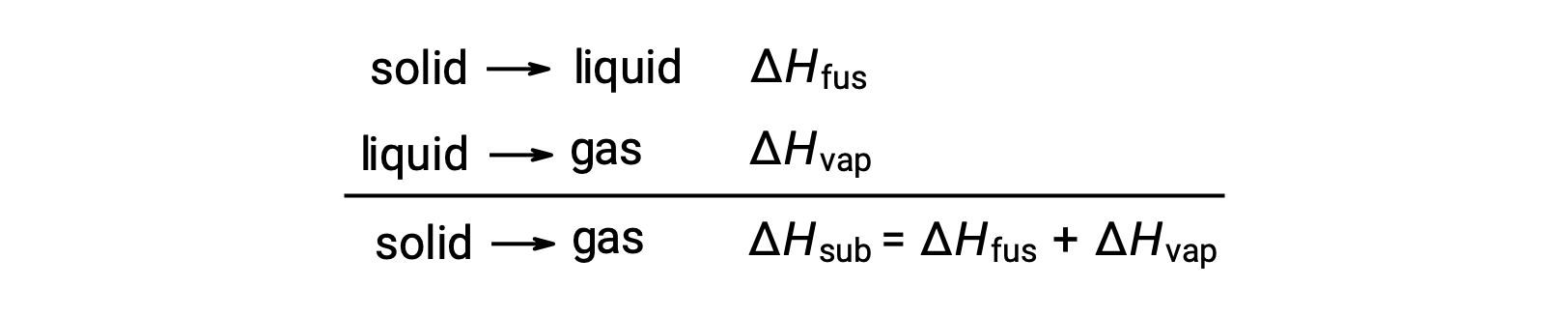
このテキストは 、 Openstax 、 Chemistry 2e 、 Section 10.3 : Phase Transitions から引用しています。


