11.12: Isınma ve Soğuma Eğrileri
Çevresinden izole edilmiş bir madde ısı değişimlerine maruz kaldığında, maddenin sıcaklık ve fazında buna karşılık gelen değişiklikler gözlenir; bu, ısıtma ve soğutma eğrileriyle grafiksel olarak temsil edilir.
Örneğin, ısı ilavesi bir katının sıcaklığını yükseltir; emilen ısı miktarı katının (q = mcsolidΔT) ısı kapasitesine bağlıdır. Termokimyaya göre, bir madde tarafından emilen veya salınan ısı miktarı q ile buna eşlik eden sıcaklık değişimi ΔT arasındaki ilişki şudur:
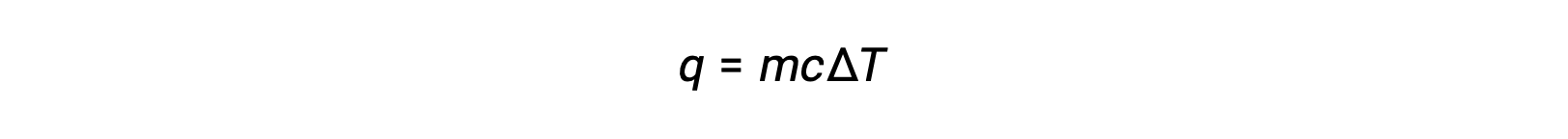
m maddenin kütlesi ve c onun özgül ısısıdır. İlişki, ısıtılan veya soğutulan ancak durum değiştirmeyen madde için geçerlidir.
Sıcaklık yeterince yükseldiğinde katı erimeye başlar (Figure 1, A noktası). Emilen ısı, katının ısı kapasitesine (q = mckatıΔT) bağlıdır ve erime noktasında bir plato gözlemlenir. Plato, katıdan sıvıya bir durum değişikliğini gösterir ve bu sırada sıcaklık, füzyon ısısı (q = mΔHfüzyon) nedeniyle yükselmez. Başka bir deyişle, daha fazla ısı kazancı, moleküler kinetik enerjilerin artması yerine, moleküller arası çekimlerin azalmasının bir sonucudur. Sonuç olarak, bir madde durum değiştirirken sıcaklığı sabit kalır.
Katı tamamen eridikten sonra (Figure 1, B noktası) sıvı ısınmaya başlar ve sıcaklıkta bir artış yaşanır. Emilen ısı, sıvının ısı kapasitesine (q = mcsıvıΔT) bağlıdır. Sıvı kaynama noktasına ulaştığında, sıvı buharlaşmaya ((Figure 1, C noktası)) başlar ve sürekli ısı girişine rağmen sıcaklık sabit kalır. Buharlaşma ısısından (q = mΔHvap) dolayı sıvıdan gaza geçiş sırasında sıvının kaynama noktasında başka bir plato (sabit sıcaklık) gözlenir. Bu aynı sıcaklık, kaynadığı sürece sıvı tarafından korunur. Isı daha yüksek bir oranda sağlanırsa, sıvının sıcaklığı yükselmez, bunun yerine kaynama daha kuvvetli (hızlı) hale gelir. Tüm sıvı buharlaştıktan (Figure 1, D noktası) sonra gazın sıcaklığı artar.
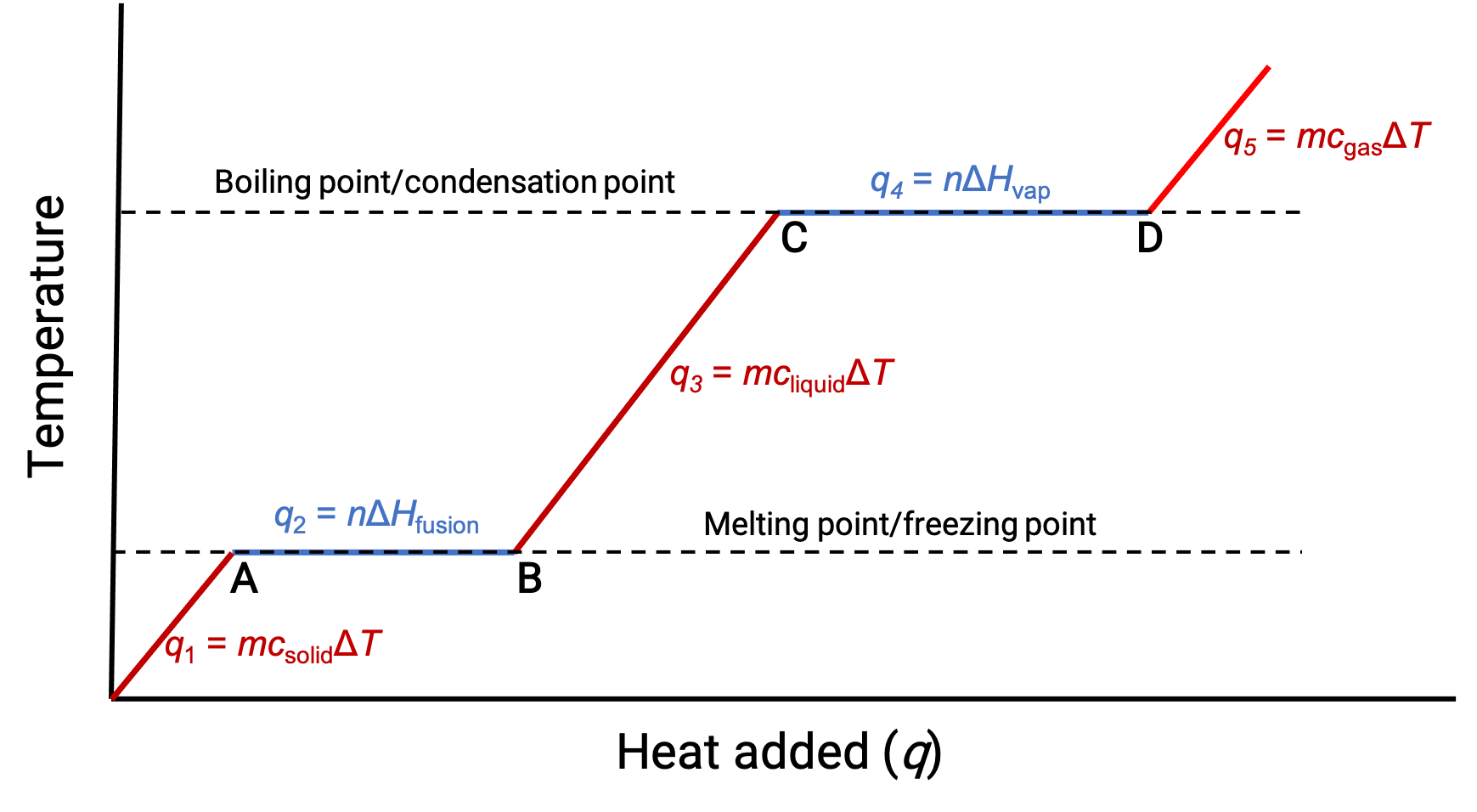
Figure 1. Bir maddenin temsili ısıtma eğrisi, maddenin artan miktarlarda ısıyı emmesiyle sonuçlanan sıcaklık değişimlerini gösterir. Eğrideki platolar (sabit sıcaklık bölgeleri), madde faz geçişlerine girdiğinde sergilenir.
Bu metin bu kaynaktan uyarlanmıştırOpenstax, Chemistry 2e, Section 10.3: Phase Transitions.


