11.12: Courbes de température de changement d'état
Lorsqu'une substance, isolée de son environnement, est soumise à des variations de chaleur, les changements correspondants de la température et de la phase de la substance sont observés, ce qui est représenté graphiquement par des courbes d'échauffement et de refroidissement.
Par exemple, l'ajout de chaleur augmente la température d'un solide ; la quantité de chaleur absorbée dépend de la capacité thermique du solide (q = mcsolideΔT). Selon la thermochimie, la relation entre la quantité de chaleur absorbée ou libérée par une substance, q, et le changement de température qui l'accompagne, ΔT, est :
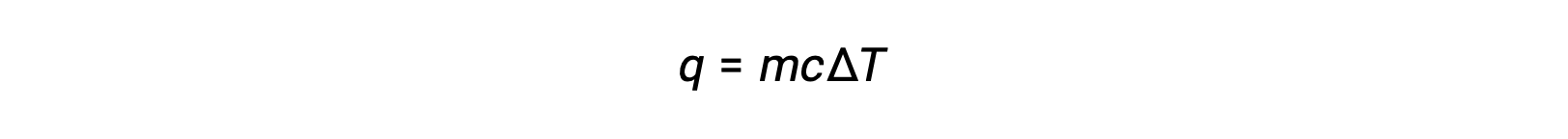
où m est la masse de la substance, et c est sa chaleur spécifique. La relation s'applique à la matière qui est chauffée ou refroidie, mais qui ne change pas d'état.
Lorsque la température est suffisamment élevée, le solide commence à fondre (figure 1, point A). La chaleur absorbée dépend de la capacité thermique du solide (q = mcsolideΔT), et un plateau est observé à son point de fusion. Le plateau indique un changement d'état de solide à liquide, pendant lequel la température n'augmente pas en raison de la chaleur de fusion (q = mΔHfusion). En d'autres termes, un gain de chaleur supplémentaire est le résultat de la diminution des attractions intermoléculaires, au lieu d'une élévation des énergies cinétiques moléculaires. Par conséquent, lorsqu'une substance change d'état, sa température reste constante.
Une fois que le solide a complètement fondu (figure 1, point B), le liquide commence à se réchauffer et subit une hausse de température. La chaleur absorbée dépend de la capacité thermique du liquide (q =mcliquideΔT). Lorsque le liquide atteint son point d'ébullition, il commence à se vaporiser (figure 1, point C) et la température reste constante malgré l'apport continu en chaleur. Un autre plateau (température constante) est observé au point d'ébullition du liquide pendant la transition de liquide à gaz en raison de la chaleur de vaporisation (q =mΔHvap). Cette même température est maintenue par le liquide tant qu'il est en ébullition. Si la chaleur est fournie à une vitesse plus élevé, la température du liquide n'augmente pas, mais au lieu de cela, l'ébullition devient plus vigoureuse (rapide). Une fois que tout le liquide s'est vaporisé (figure 1, point D), la température du gaz augmente.
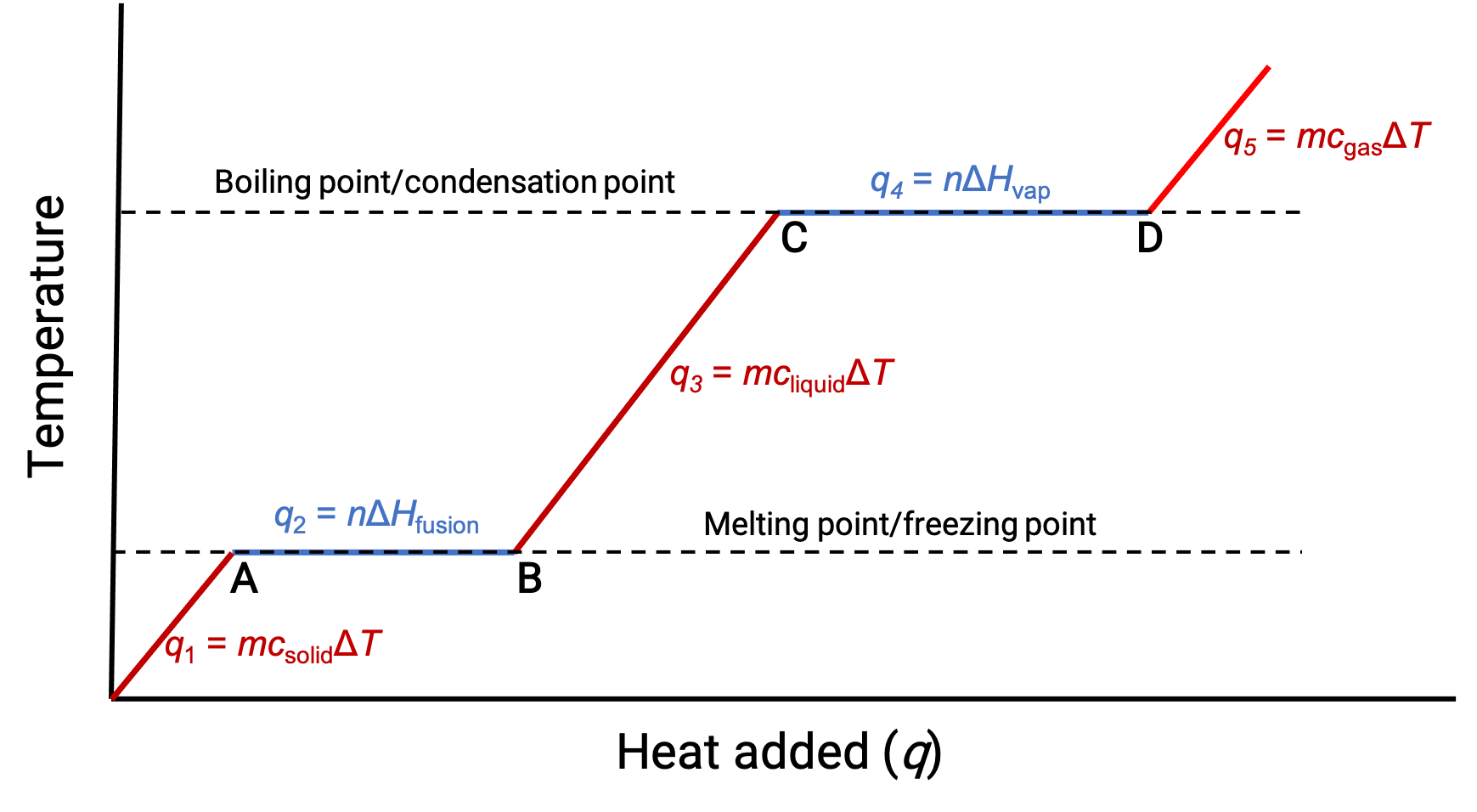
Figure 1. La courbe d'échauffement représentative d'une substance décrit les changements de température qui résultent du fait que la substance absorbe des quantités croissantes de chaleur. Des plateaux sur la courbe (régions de température constante) se produisent lorsque la substance subit des transitions de phases.
Ce texte est adapté de Openstax, Chimie 2e, Section 10.3 : Transitions de phases.


