11.13: Diagramas de Fase
Um diagrama de fase combina gráficos de pressão versus temperatura para os equilíbrios de transição de fase líquido-gás, sólido-líquido, e sólido-gás de uma substância. Estes diagramas indicam os estados físicos que existem em condições específicas de pressão e temperatura e também fornecem a dependência de pressão das temperaturas de transição de fase (pontos de fusão, pontos de sublimação, pontos de ebulição). As regiões ou áreas marcadas com sólido, líquido, e gás representam fases únicas, enquanto que as linhas ou curvas representam duas fases coexistentes em equilíbrio (ou pontos de mudança de fase). O ponto triplo indica condições de pressão e temperatura onde coexistem as três fases. Em contraste, um ponto crítico indica a temperatura e a pressão acima da qual existe uma única fase—cujas propriedades físicas são intermediárias entre os estados gasoso e líquido.
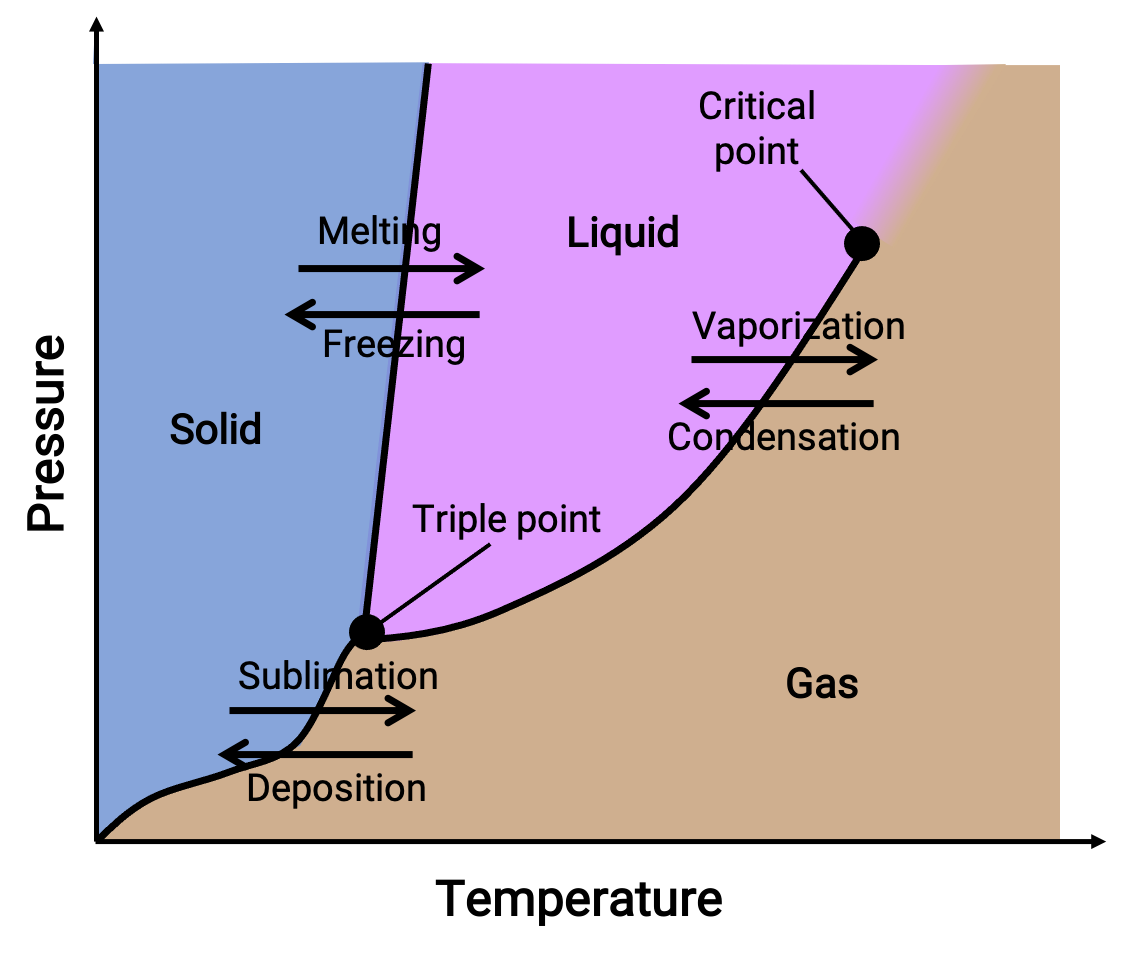
Figura 1. Um diagrama de fase típico.
Um diagrama de fase identifica o estado físico de uma substância em condições específicas de pressão e temperatura. Para ilustrar a utilidade destes gráficos, considere o diagrama de fase da água, mostrado abaixo.
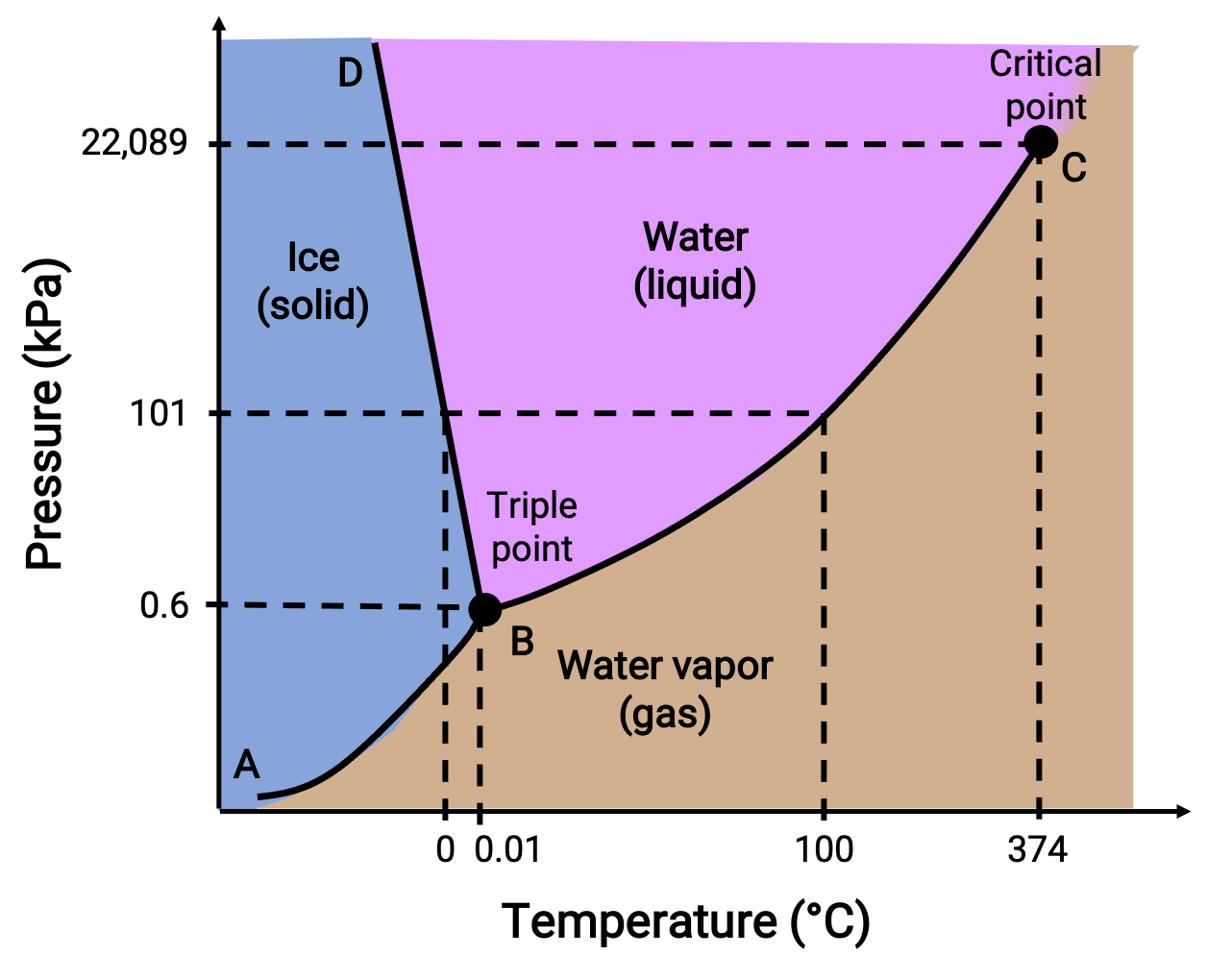
Figura 2. Diagrama de fase da água.
Uma pressão de 50 kPa e uma temperatura de −10 °C correspondem à região do diagrama identificada como “gelo”. Sob estas condições, a água existe somente como um sólido. Uma pressão de 50 kPa e uma temperatura de 50 °C correspondem à região onde a água existe apenas como líquido. A 25 kPa e 200 °C, a água só existe no estado gasoso. A curva BC é a curva líquido-vapor que separa as regiões líquidas e gasosas do diagrama de fase e fornece o ponto de ebulição para a água a qualquer pressão. Por exemplo, a 1 atm, o ponto de ebulição é de 100 °C. Observe que a curva líquido-vapor termina a uma temperatura de 374 °C e a uma pressão de 218 atm, indicando que a água não pode existir como líquido acima dessa temperatura, independentemente da pressão. As propriedades físicas da água nessas condições são intermediárias entre as das suas fases líquida e gasosa. Este estado único da matéria é chamado um fluido supercrítico. A curva de sólido-vapor marcada como AB, indica as temperaturas e pressões nas quais o gelo e o vapor de água estão em equilíbrio. Estes pares de dados de temperatura-pressão correspondem aos pontos de sublimação, ou deposição, da água.
A curva sólido-líquido marcada como BD mostra as temperaturas e pressões nas quais o gelo e a água líquida estão em equilíbrio, representando os pontos de fusão/solidificação da água. Note que esta curva apresenta um ligeiro declive negativo, indicando que o ponto de fusão da água diminui ligeiramente à medida que a pressão aumenta. A água é uma substância invulgar a este respeito, uma vez que a maioria das substâncias apresenta um aumento do ponto de fusão com uma pressão crescente. O ponto de intersecção das três curvas—marcado como B—é o ponto triplo da água, onde todas as três fases coexistem em equilíbrio. A pressões inferiores ao ponto triplo, a água não pode existir como líquido, independentemente da temperatura.
Considere o diagrama de fase para o dióxido de carbono como outro exemplo.
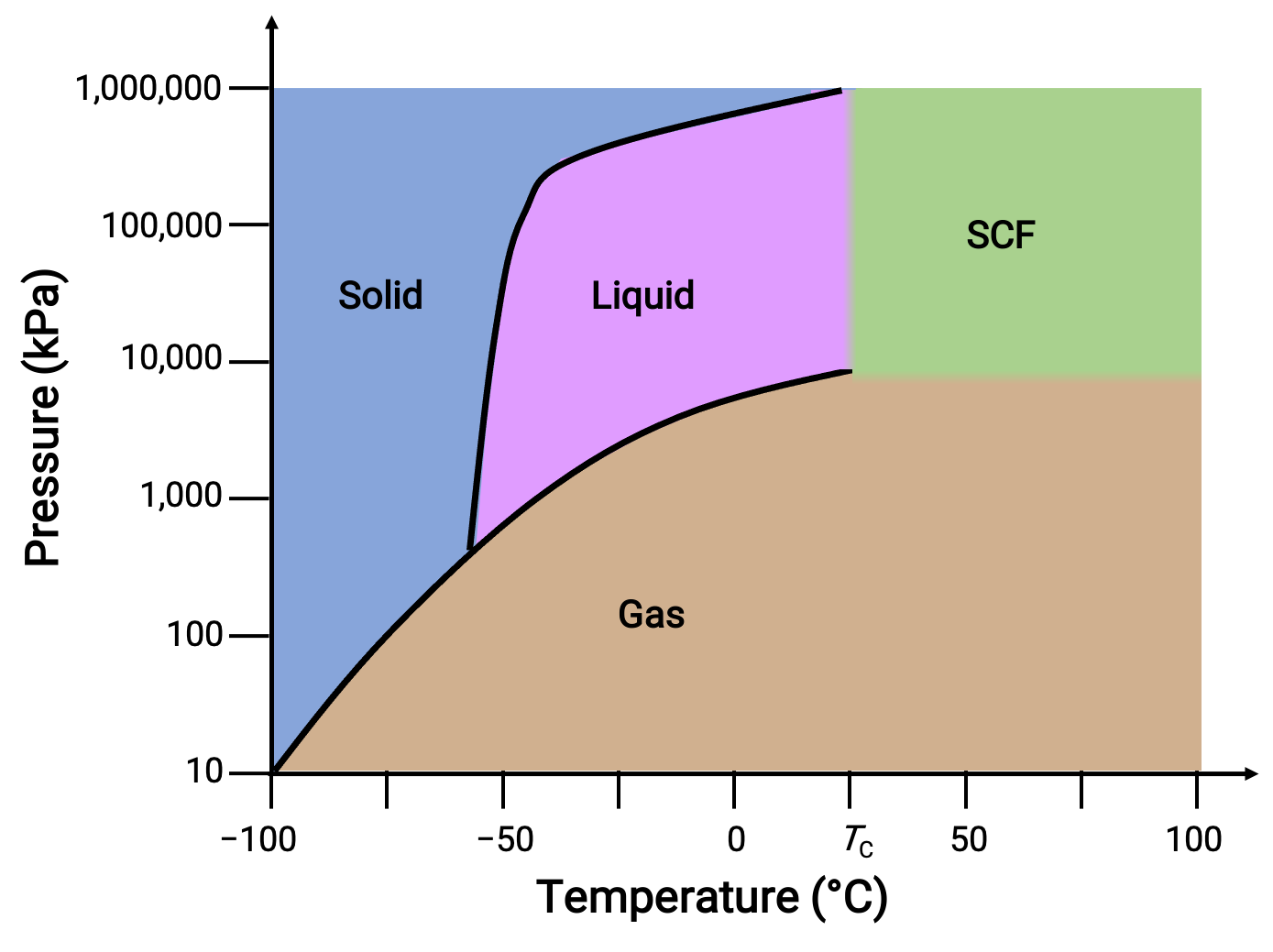
Figura 3. Diagrama de fase do dióxido de carbono.
A curva sólido-líquido apresenta um declive positivo, indicando que o ponto de fusão do CO2 aumenta com a pressão tal como acontece para a maioria das substâncias. Observe que o ponto triplo está bem acima de 1 atm, indicando que o dióxido de carbono não pode existir como líquido sob condições de pressão ambiente. Em vez disso, arrefecer dióxido de carbono gasoso a 1 atm resulta na sua deposição no estado sólido. Do mesmo modo, o dióxido de carbono sólido não derrete a uma pressão de 1 atm mas, em vez disso, sublima para produzir CO2 gasoso. Por fim, o ponto crítico para o dióxido de carbono é observado a uma temperatura e pressão relativamente modestas em comparação com a água.
Este texto é adaptado de Openstax, Chemistry 2e, Section 10.4: Phase Diagrams.


