11.14: Structures des solides
Les solides dans lesquels les atomes, les ions ou les molécules sont disposés selon un motif répétitif défini sont appelés des solides cristallins. Les métaux et les composés ioniques forment généralement des solides cristallins ordonnés. Un solide cristallin a une température de fusion précise parce que chaque atome ou molécule du même type est maintenu en place avec les mêmes forces ou la même énergie. Les solides amorphes, ou solides non cristallins (ou parfois verres), qui n'ont pas de structure interne ordonnée et sont disposés de façon aléatoire. Les substances qui se composent de grandes molécules, ou d'un mélange de molécules dont les mouvements sont plus limités, forment souvent des solides amorphes. Le matériau amorphe devient mou progressivement, sur une plage de températures, en raison de la non-équivalence structurelle des molécules. Lorsqu'un matériau amorphe est chauffé, les attractions intermoléculaires les plus faibles sont rompues en premier. À mesure que la température augmente, des attractions plus fortes sont rompues.
Maille
La structure d'un solide cristallin est mieux décrite par son unité de répétition la plus simple, appelée maille. La maille est constituée des nœuds du réseau qui représentent les emplacements des atomes ou des ions. L'ensemble de la structure est alors constitué de cette maille qui se répète en trois dimensions, comme illustré dans la figure 1.
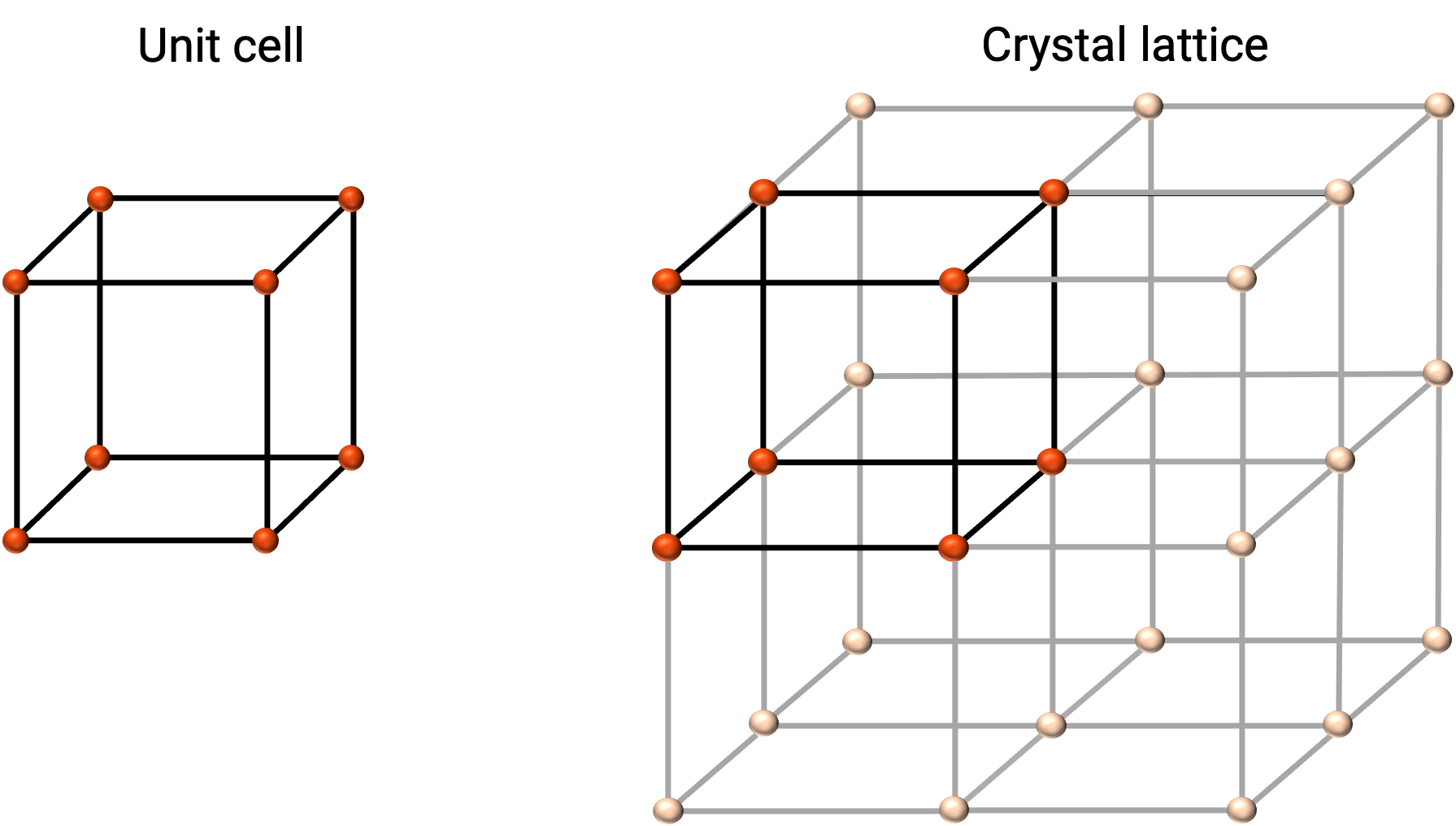
Figure 1. Maille et réseau cristallin avec les points du réseau indiqués en rouge.
En général, une maille est définie par les longueurs de trois axes (a, b et c) et les angles (α, β et γ) entre eux, comme illustré dans la figure 2. Les axes sont définis comme étant les longueurs entre les nœuds du réseau dans l'espace.
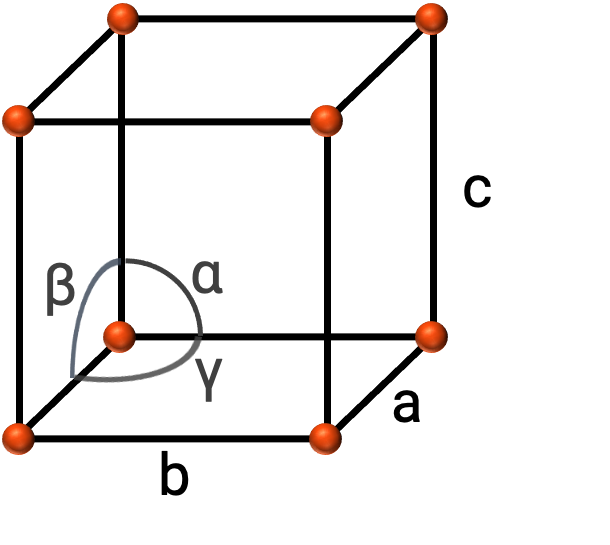
Figure 2. La maille est définie par ses axes (a, b et c) et ses angles (α, β, et γ)
Il existe sept systèmes de réseaux différents, dont certains ont plus d'un type de réseau, pour un total de quatorze mailles différentes.
| Systèmes | Angles | Axes |
| Cubique | α = β = γ = 90° | a = b = c |
| Tétragonal | α = β = γ = 90° | a = b ≠ c |
| Orthorhombique | α = β = γ = 90° | a ≠ b ≠ c |
| Monoclinique | α = γ = 90° ; β ≠ 90° | a ≠ b ≠ c |
| Triclinique | α ≠ β ≠ γ ≠ 90° | a ≠ b ≠ c |
Ce texte est adapté deOpenstax, Chimie 2e, Section 10.6 : Structures du réseau dans les solides cristallins.


