11.14: Katıların Yapısı
Atomların, iyonların veya moleküllerin belirli bir tekrar eden modelde düzenlendiği katılar, kristalin katılar olarak bilinir. Metaller ve iyonik bileşikler tipik olarak düzenli, kristal katıları oluşturur. Kristal bir katı, aynı tipteki her atom veya molekül aynı kuvvet veya enerji ile yerinde tutulduğu için kesin bir erime sıcaklığına sahiptir. Düzenli bir iç yapıya sahip olmayan ve rastgele düzenlenmiş şekilsiz katılar veya kristal olmayan katılar (veya bazen camlar). Büyük moleküllerden veya hareketleri daha kısıtlı olan moleküllerin bir karışımından oluşan maddeler, genellikle şekilsiz katılar oluşturur. Amorf malzeme, moleküllerin yapısal eşdeğerli olmamasından dolayı bir dizi sıcaklıkta kademeli olarak yumuşamaya uğrar. Amorf bir malzeme ısıtıldığında, önce en zayıf moleküller arası çekimler kırılır. Sıcaklık daha da yükseldikçe, daha güçlü çekimler bozuluyor.
Birim Hücre
Kristal bir katının yapısı, en iyi, birim hücresi olarak adlandırılan, tekrar eden en basit birimi ile tanımlanır. Birim hücre, atomların veya iyonların yerlerini temsil eden kafes noktalarından oluşur. Tüm yapı, Şekil 1'de gösterildiği gibi, üç boyutta tekrar eden bu birim hücreden oluşur.
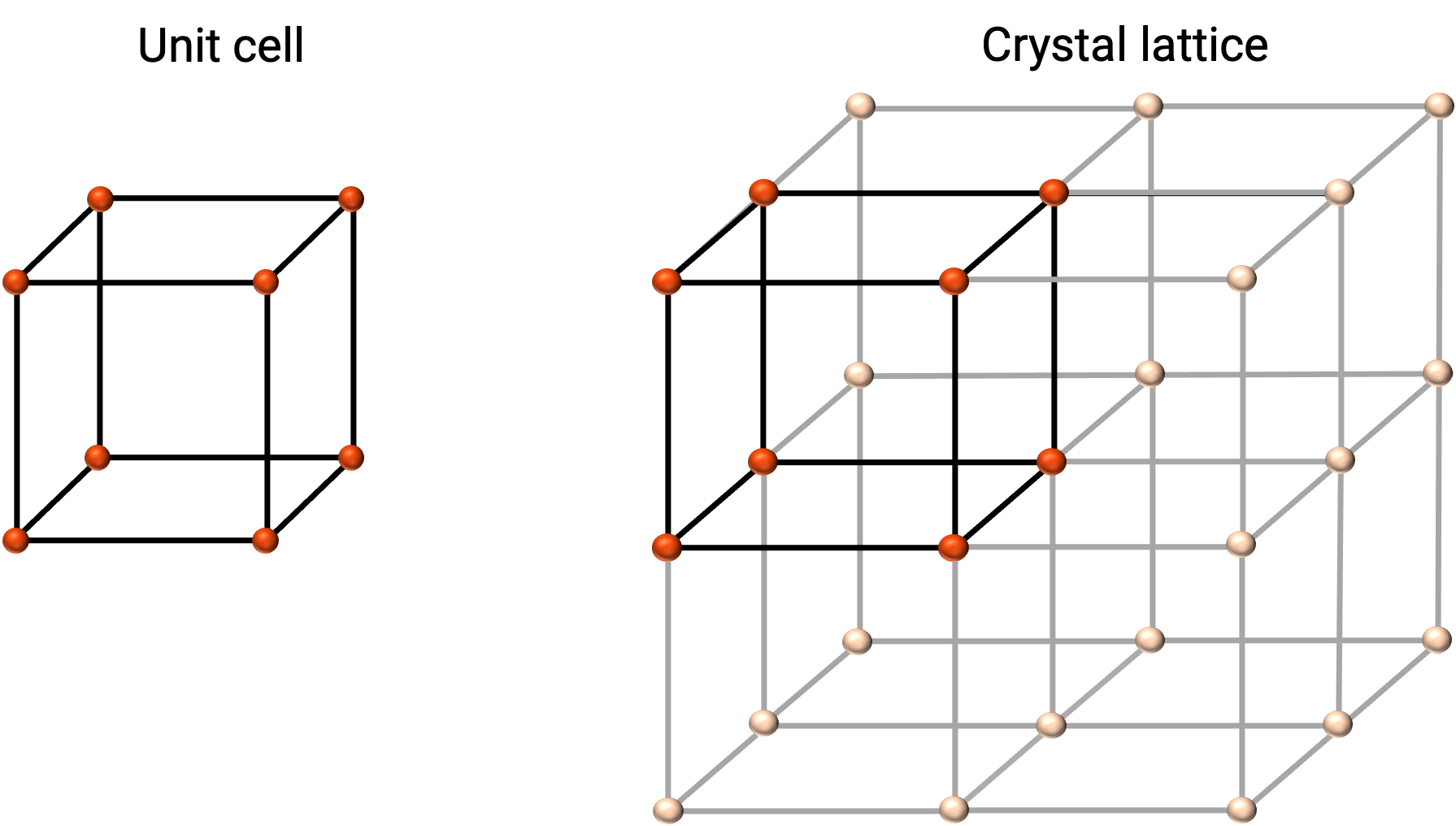
Şekil 1. Birim hücreler ve kristal örgülerin, örgü noktaları kırmızı ile gösterilmiştir.
Genel olarak, bir birim hücre, Şekil 2'de gösterildiği gibi üç eksenin (a, b, ve c) uzunlukları ve aralarındaki açılarla (α, β, ve γ) tanımlanır. Eksenler, boşluk kafesindeki noktalar arasındaki uzunluklar olarak tanımlanır.
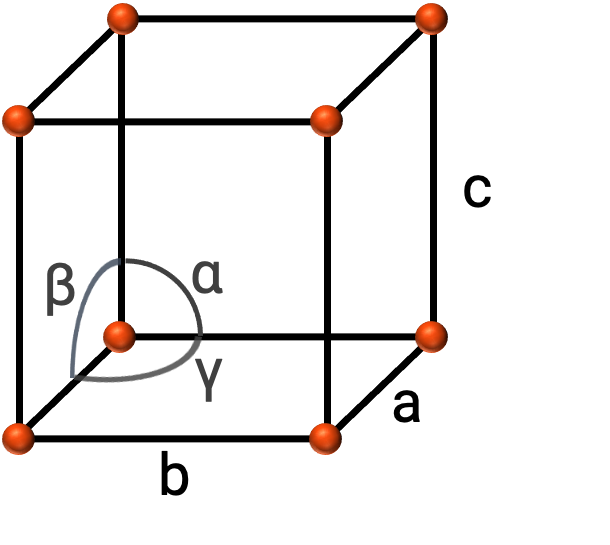
ŞEkil 2. Birim hücre eksenleri ile tanımlanmıştır (a, b, ve c), ve açılar (α, β, ve γ)
Toplam on dört farklı birim hücre için bazıları birden fazla kafes tipine sahip yedi farklı kafes sistemi vardır.
| Sistemler | Açılar | Eksenler |
| Kübik | α = β = γ = 90° | a = b = c |
| Tetragonal | α = β = γ = 90° | a = b ≠ c |
| Ortorombik | α= β = γ = 90° | a ≠ b ≠ c |
| Monoklinik | α = γ = 90°; β ≠ 90° | a ≠ b ≠ c |
| Triklinik | α ≠ β ≠ γ ≠ 90° | a ≠ b ≠ c |
Bu metin bu kaynaktan uyarlanmıştır Openstax, Chemistry 2e, Section 10.6: Lattice Structures in Crystalline Solids.


