12.12: 电解质: 范特霍夫因子(van't Hoff Factor)
电解质的依数性
溶液的依数性仅取决于溶质物种溶解的编号,而不是身份。 各种依数性 (凝固点降低,沸点升高,渗透压) 等式中的浓度术语与溶液中的所有溶质物种相关。 非电解质物理溶解,不带离解或任何其他随附过程。 每个溶解的分子产生一个溶解的溶质分子。 但是,电解质的溶解并不简单,如下两个常见示例所示:
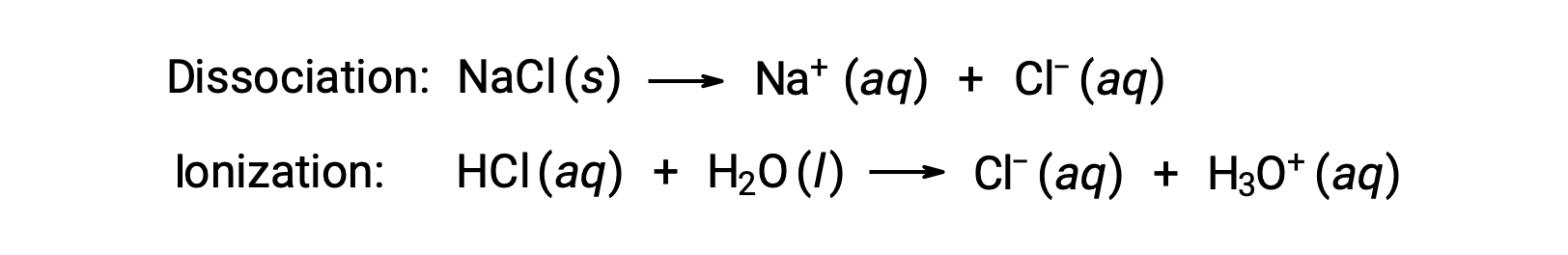
考虑到这些示例中的第一个,假设是完全解离, 1.0 m 水溶液 of NaCl 每千克水中含有 2.0 摩尔离子 (1.0 摩尔纳 + 和 1.0 摩尔 CL−) ,预计其凝固点降低将为
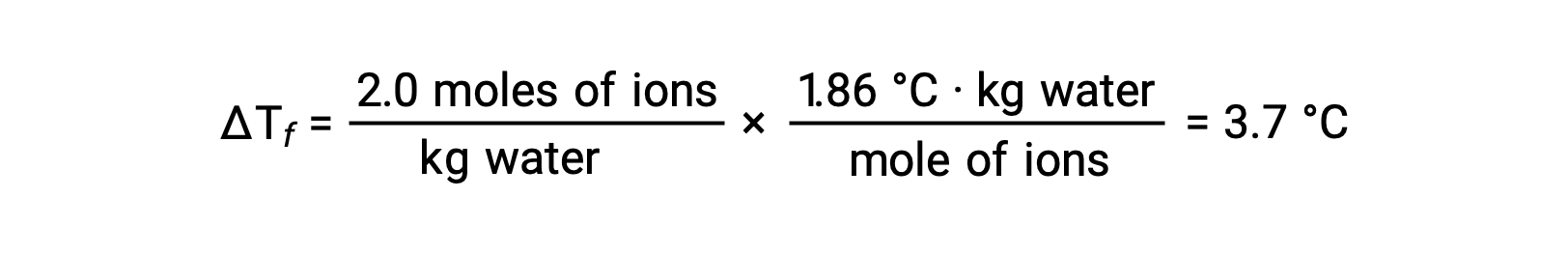
但是,当实际准备好此溶液并测量其凝固点降低时,将获得 3.4 °C 的值。 观察到其他离子化合物也存在类似差异,随着溶质浓度的增加,测得的和预期的同形成属性值之间的差异通常会变得更加显著。 这些观察表明,氯化钠 (和其他强电解质) 的离子在溶液中没有完全分离。
为了对此进行解释并避免假设完全解离时出现错误,使用了一个名为以纪念诺贝尔化学家 雅各布斯·亨里克斯·范特霍夫(Jacobus Henricus van't Hoff) 的实验测量参数。 范特霍夫因子(van't Hoff Factor) (i) 定义为溶液中的溶质粒子与公式单位数溶解的比率:

1923 年,化学家 彼得·德拜(Peter Debye) 和 埃里希·休克尔(Erich Hückel) 提出了一种理论来解释强电解质明显不完整的电离。 他们指出,尽管水溶液中的离子离子吸引力通过离子溶化和极溶剂的绝缘作用而大大降低,但它并未完全失效。 残留吸引力可防止离子表现为完全独立的粒子。 在某些情况下,正负离子实际上可能会接触,从而产生一个称为离子对的溶剂化单元。 因此,任何特定类型的离子的活性或有效浓度都小于实际浓度所示的活性或有效浓度。 随着溶液变稀,残留离子离子吸引力变少,离子分离越来越广泛。 因此,在极为稀疏的溶液中,离子 (其活性) 的有效浓度基本上等于实际浓度。 对于 0.05 米溶液, NaCl 的 I 值为 1.9 ,而理想值为 2。
本文改编自 Openstax, 化学 2e, 第 11.4 节:依数性。


