12.12: 電解質:ファントホフ係数
電解質の束一的性質
溶液の束一的性質は、溶解している溶質種の種類ではなく、その数にのみ依存します。様々な束一的性質(凝固点降下、沸点上昇、浸透圧)の式における濃度項は、溶液中に存在するすべての溶質種に関係します。非電解質は、解離やその他の付随するプロセスなしに物理的に溶解します。溶解する各分子には、溶解した溶質分子が1つ含まれます。しかし、電解質の溶解は、以下の2つの一般的な例で示されるように、必ずしも単純ではありません。
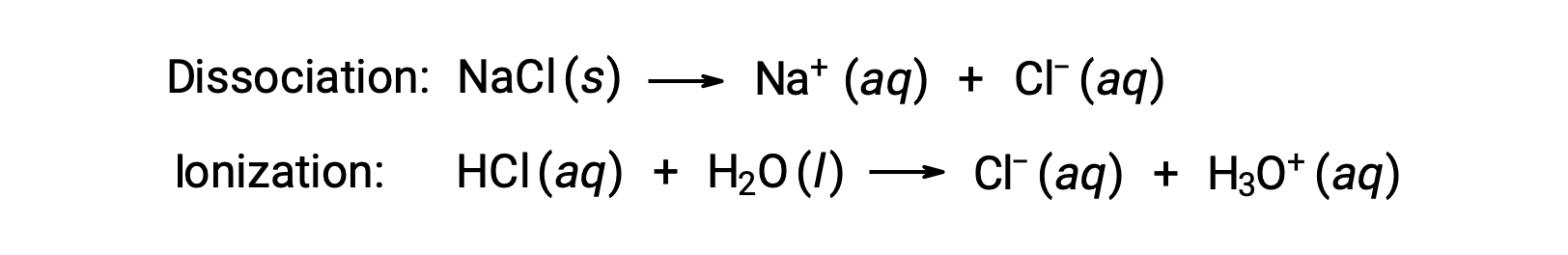
上の例について、完全に解離していると仮定すると、1.0MのNaCl水溶液は、水1 kgあたり2.0 molのイオン(1.0 molのNa+と1.0 molのCl−)を含み、その凝固点降下量は次の通りです。
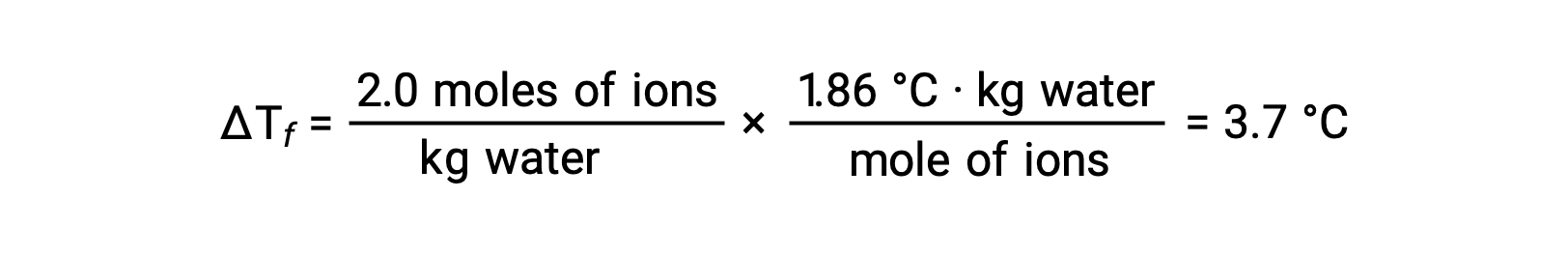
しかし、この溶液を実際に用意して、その凝固点降下を測定すると、3.4 °Cという値が得られます。他のイオン性化合物でも同様の違いが見られ、実測値と期待値の差は、溶質の濃度が高くなるほど大きくなるのが一般的です。これらの観察結果は、塩化ナトリウム(およびその他の強電解質)のイオンが溶液中で完全には解離していないことを示唆しています。
この完全解離の仮定に伴う誤差を回避するために、ノーベル賞を受賞したドイツの化学者ジェイコブス・ヘンリクス・ファントホフに敬意を表して名付けられた、実験的に測定されたパラメータが使用されています。ファントホフ係数(i)は、溶解した式単位の数に対する溶液中の溶質粒子の比率として定義されます。

1923年、化学者のピーター・デバイとエーリヒ・ヒュッケルは、強電解質の電離が明らかに不完全であることを説明しました。この説では、水溶液中のイオン間引力は、イオンの溶媒和と極性溶媒の遮蔽作用によって非常に小さくなりますが、完全になくなるわけではありません。そのため、イオンが完全に独立した粒子として振る舞うことはできません。場合によっては、プラスとマイナスのイオンが実際に接触し、イオン対と呼ばれる溶媒和されたユニットができることもあります。このようにして、ある種のイオンの活性または有効濃度は、実際の濃度が示すものよりも小さくなります。イオンは、溶液の希釈度が高くなるにつれてより電離するため、残存するイオン間引力は小さくなります。したがって、非常に希薄な溶液では、イオンの有効濃度(活性)は実際の濃度と本質的に等しくなります。0.05 Mの溶液の場合、NaClのiの値は、理想的な値である2.0に対して、1.9です。
上記の文章は以下から引用しました。Openstax, Chemistry 2e, Section 11.4: Colligative Properties.から引用されている


