12.12: Eletrólitos: Factor de van't Hoff
Propriedades Coligativas dos Eletrólitos
As propriedades coligativas de uma solução dependem apenas do número, não da identidade, de espécies dissolvidas de soluto. Os termos de concentração nas equações para as diversas propriedades coligativas (depressão do ponto de solidificação, elevação do ponto de ebulição, pressão osmótica) pertencem a todas as espécies de solutos presentes na solução. Os não-eletrólitos dissolvem-se fisicamente sem dissociação ou qualquer outro processo de acompanhamento. Cada molécula que se dissolve produz uma molécula dissolvida de soluto. No entanto, a dissolução de um eletrólito não é tão simples, como ilustrado pelos dois exemplos comuns abaixo:
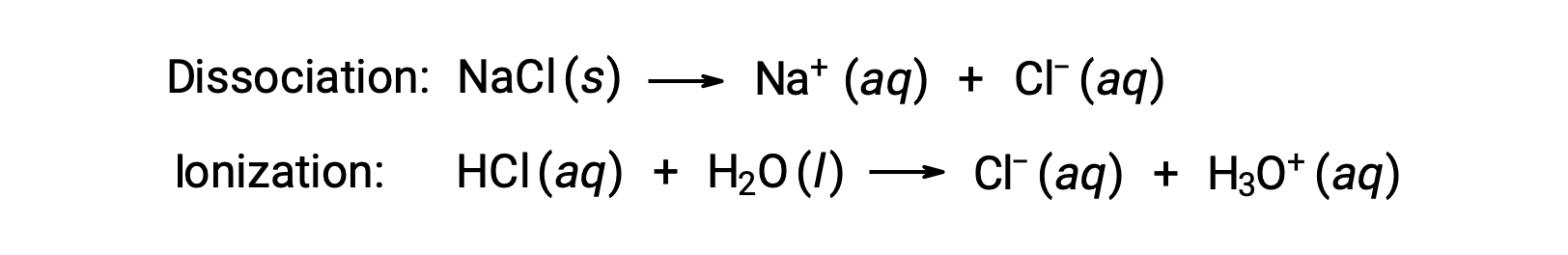
Considerando o primeiro destes exemplos, e assumindo dissociação completa, uma solução aquosa de 1,0 m de NaCl contém 2,0 moles de iões (1,0 mol Na+ e 1,0 mol Cl−) por cada quilograma de água, e espera-se que a depressão do seu ponto de solidificação seja
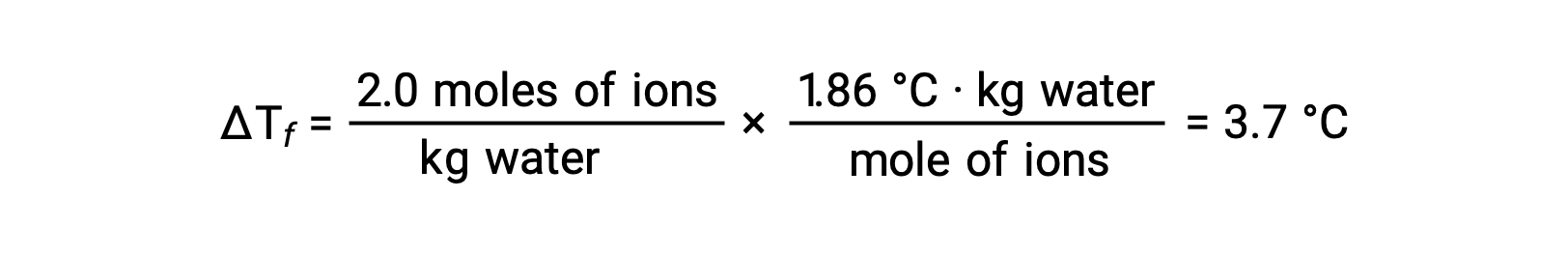
No entanto, quando esta solução é efetivamente preparada e a depressão do ponto de solidificação é medida, obtém-se um valor de 3,4 °C. Discrepâncias semelhantes são observadas para outros compostos iónicos, e as diferenças entre os valores medidos e os esperados da propriedade coligativa tornam-se tipicamente mais significativas à medida que as concentrações de soluto aumentam. Estas observações sugerem que os iões de cloreto de sódio (e outros electrólitos fortes) não estão completamente dissociados em solução.
Para explicar isso e evitar os erros que acompanham a suposição de dissociação total, é usado um parâmetro medido experimentalmente nomeado em homenagem ao químico Alemão premiado com um Prémio Nobel, Jacobus Henricus van’t Hoff. O factor van’t Hoff (i) é definido como a razão entre partículas de soluto em solução e o número de unidades de fórmula dissolvidas:

Em 1923, os químicos Peter Debye e Erich Hückel propuseram uma teoria para explicar a aparente ionização incompleta de eletrólitos fortes. Eles sugeriram que, embora a atração interiónica em uma solução aquosa seja muito reduzida pela solvatação dos iões e pela ação isolante do solvente polar, não é completamente anulada. As atrações residuais impedem que os iões se comportem como partículas totalmente independentes. Em alguns casos, um ião positivo e um negativo podem realmente tocar-se, originando uma unidade solvatada chamada de par iónico. Assim, a atividade—ou a concentração efetiva—de qualquer tipo específico de ião é inferior à indicada pela concentração real. Os iões ficam cada vez mais separados à medida que a solução se torna mais diluída e as atrações interiónicas se tornam cada vez menos. Assim, em soluções extremamente diluídas, as concentrações efetivas dos iões (as suas atividades) são essencialmente iguais às concentrações reais. Para soluções de 0,05 m, o valor de i para NaCl é de 1,9, em oposição ao valor ideal de 2.
Este texto é adaptado de Openstax, Chemistry 2e, Section 11.4: Colligative Properties.


