12.12: Électrolytes : facteur de van 't Hoff
Propriétés colligatives des électrolytes
Les propriétés colligatives d'une solution ne dépendent que du nombre d'espèces de solutés dissoutes, et non de leur identité. Les termes de la concentration dans les équations de diverses propriétés colligatives (dépression du point de congélation, élévation du point d'ébullition, pression osmotique) se rapportent à toutes les espèces de solutés présentes dans la solution. Les non-électrolytes se dissolvent physiquement sans dissociation ni aucun autre processus d'accompagnement. Chaque molécule qui se dissout produit une molécule de soluté dissoute. Toutefois, la dissolution d'un électrolyte n'est pas aussi simple, comme l'illustrent les deux exemples fréquents ci-dessous :
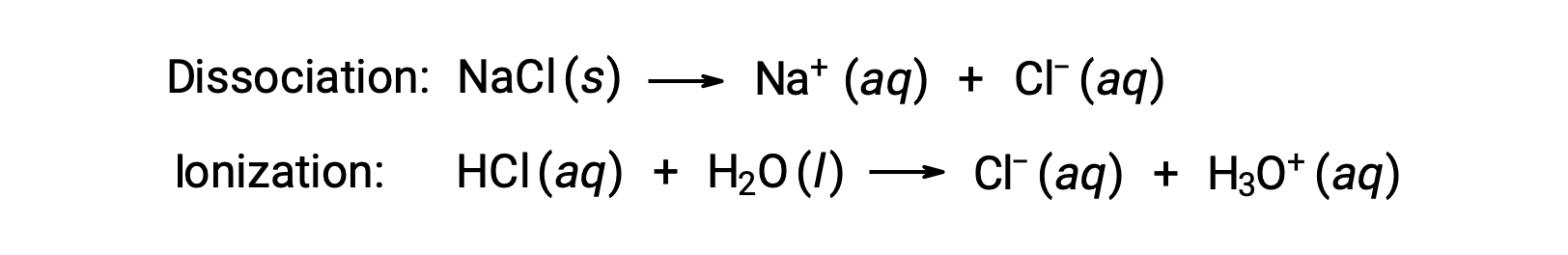
Compte tenu du premier de ces exemples, et en supposant une dissociation complète, une solution aqueuse de NaCl de 1,0 m contient 2,0 moles d'ions (1,0 mol Na+ et 1,0 mol Cl−) par kilogramme d'eau, et on s'attend à ce que la dépression de son point de congélation soit de
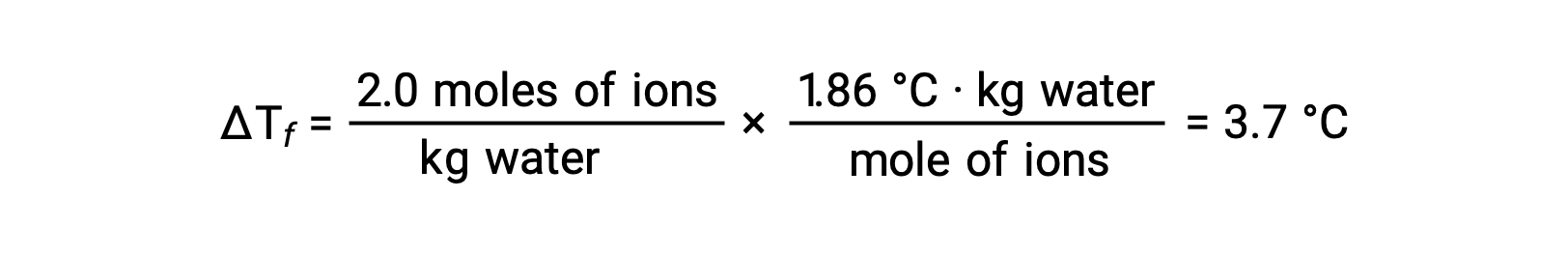
Cependant, lorsque cette solution est réellement préparée et que la dépression de son point de congélation est mesurée, une valeur de 3,4 °C est obtenue. Des écarts similaires sont observés pour d'autres composés ioniques, et les différences entre les valeurs mesurées et les valeurs prévues des propriétés colligatives deviennent généralement plus importantes à mesure que les concentrations de soluté augmentent. Ces observations indiquent que les ions de chlorure de sodium (et d'autres électrolytes forts) ne sont pas complètement dissociés en solution.
Pour tenir compte de cela et éviter les erreurs qui accompagnent la supposition d'une dissociation totale, un paramètre mesuré expérimentalement nommé en l'honneur du chimiste allemand lauréat du prix Nobel Jacobus Henricus van’t Hoff est utilisé. Le facteur Van't Hoff (i) est défini comme le rapport entre les particules de soluté en solution et le nombre d'unités de formule dissoutes :

En 1923, les chimistes Peter Debye et Erich Hückel ont proposé une théorie pour expliquer l'ionisation incomplète apparente des électrolytes forts. Ils ont suggéré que, bien que l'attraction interionique dans une solution aqueuse soit très réduite par la solvatation des ions et l'action d'isolation du solvant polaire, elle n'est pas complètement annulée. Les attractions résiduelles empêchent les ions de se comporter comme des particules totalement indépendantes. Dans certains cas, un ion positif et négatif peuvent vraiment se toucher, donnant une unité solvatée appelée une paire d'ions. Ainsi, l'activité — ou la concentration effective — d'un type d'ion particulier est inférieure à celle indiquée par la concentration réelle. Les ions sont de plus en plus éloignés à mesure que la solution devient plus diluée et que les attractions interioniques résiduelles deviennent de moins en moins nombreuses. Ainsi, dans les solutions extrêmement diluées, les concentrations effectives des ions (leurs activités) sont essentiellement égales aux concentrations réelles. Pour les solutions de 0,05 m, la valeur de i pour NaCl est de 1,9 par opposition à une valeur idéale de 2.
Ce texte est adapté de Openstax, Chimie 2e, Section 11.4 : Propriétés colligatives.


