12.13: Coloides
As crianças a brincar fazem frequentemente suspensões tais como misturas de lama com água, farinha com água, ou uma suspensão de pigmentos sólidos em água conhecida como a pintura de têmpera. Estas suspensões são misturas heterogéneas compostas por partículas relativamente grandes que são visíveis a olho nu ou que podem ser vistas com uma lupa. São turvas, e as partículas suspensas depositam-se depois de se misturarem. Por outro lado, uma solução é uma mistura homogénea na qual não ocorre qualquer assentamento e na qual as espécies dissolvidas são moléculas ou iões. As soluções apresentam um comportamento completamente diferente das suspensões. Uma solução pode ter cor, mas é transparente, as moléculas ou iões são invisíveis, e não assentam ao parar. Outra classe de misturas chamadas coloides (ou dispersões coloidais) apresenta propriedades intermediárias entre as de suspensões e soluções. As partículas em um coloide são maiores do que a maioria das moléculas simples; no entanto, as partículas coloidais são pequenas o suficiente para que não assentem ao parar.
Preparação de Sistemas Coloidais
Os coloides são preparados produzindo partículas de dimensões coloidais e distribuindo essas partículas por meio de dispersão. As partículas de tamanho coloidal são formadas por dois métodos:
• Métodos de dispersão: quebrando partículas maiores. Por exemplo, os pigmentos de tinta são produzidos pela dispersão de partículas grandes através de moagem em moinhos especiais.
• Métodos de condensação: crescimento de unidades menores, como moléculas ou iões. Por exemplo, as nuvens formam-se quando as moléculas de água se condensam e formam gotas muito pequenas.
Algumas substâncias sólidas, quando colocadas em contacto com a água, dispersam-se espontaneamente e formam sistemas coloidais. A gelatina, a cola, o amido, e o pó de leite desidratado comportam-se desta forma. As partículas já são de tamanho coloidal; a água simplesmente as dispersa. As partículas de leite em pó de tamanho coloidal são produzidas por desidratação de spray de leite. Alguns atomizadores produzem dispersões coloidais de um líquido no ar.
Uma emulsão pode ser preparada agitando ou misturando dois líquidos imiscíveis. Isto quebra um líquido em gotículas de tamanho coloidal, que se dispersam então por todo o outro líquido. Os derrames de óleo no oceano podem ser difíceis de limpar, em parte porque a ação das ondas pode fazer com que o óleo e a água formem uma emulsão. Em muitas emulsões, no entanto, a fase dispersa tende a coalescer, formar grandes gotas, e separar-se. Portanto, as emulsões são geralmente estabilizadas por um agente emulsionante, uma substância que inibe a coalescência do líquido disperso. Por exemplo, um pouco de sabão irá estabilizar uma emulsão de petróleo em água. O leite é uma emulsão de nata em água, com a caseína proteica a servir como agente emulsionante. A maionese é uma emulsão de óleo em vinagre, com componentes da gema de ovo como agentes emulsionantes.
Os métodos de condensação formam partículas coloidais através da agregação de moléculas ou iões. Se as partículas crescerem para além da gama de tamanho coloidal, formam-se gotas ou precipitados, e nenhum sistema coloidal resulta. As nuvens formam-se quando as moléculas de água agregam e formam partículas de tamanho coloidal. Se estas partículas de água coalescerem para formar gotas adequadamente grandes de água líquida ou cristais de água sólida, elas se assentam do céu como chuva, gelo, ou neve. Muitos métodos de condensação envolvem reações químicas. A suspensão coloidal vermelha do hidróxido de ferro(III) pode ser preparada misturando uma solução concentrada de cloreto de ferro(III) com água quente:

Um sol de ouro coloidal resulta da redução de uma solução muito diluída de cloreto de ouro(III) por um agente redutor como formaldeído, cloreto de estanho(II), ou sulfato de ferro(II):
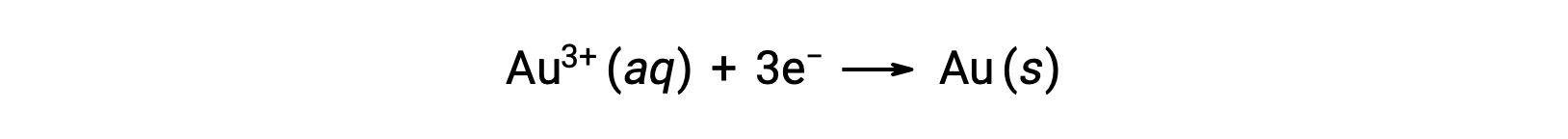
Alguns sóis de ouro preparados em 1857 ainda estão intactos (as partículas não coalesceram e assentaram), ilustrando a estabilidade a longo prazo de muitos coloides.
Sabões e Detergentes
Os pioneiros faziam sabão fervendo gorduras com uma solução fortemente básica feita por lixiviação de carbonato de potássio, K2CO3, a partir de cinzas de madeira com água quente. As gorduras animais contêm poliésteres de ácidos gordos (ácidos carboxílicos de cadeia longa). Quando as gorduras animais são tratadas com uma base como o carbonato de potássio ou o hidróxido de sódio, formam-se glicerol e sais de ácidos gordos como os ácidos palmítico, oleico, e esteárico. Os sais dos ácidos gordos são chamados sabões. O sal de sódio do ácido esteárico, estearato de sódio, contém uma cadeia de hidrocarbonetos não polares não carregada, a unidade C17H35, e um grupo carboxilato iónico, a unidade COO−.
A ação de limpeza de sabões e detergentes pode ser explicada em termos das estruturas das moléculas envolvidas. A extremidade de hidrocarboneto (não polar) de uma molécula de sabão ou detergente dissolve-se ou é atraída por substâncias não polares, como óleo, gordura, ou partículas de sujidade. A extremidade iónica é atraída pela água (polar). Como resultado, as moléculas de sabão ou detergente ficam orientadas na interface entre as partículas de sujidade e a água, para que atuem como uma espécie de ponte entre dois tipos diferentes de matéria, não polar e polar. Moléculas como esta são chamadas de anfifílicas, uma vez que têm uma parte hidrofóbica (“temente de água”) e uma parte hidrofílica (“amante de água”). Como consequência, as partículas de sujidade ficam suspensas como partículas coloidais e são imediatamente lavadas.
Este texto é adaptado de Openstax, Chemistry 2e, Section 11.5: Colloids.


