13.4: 反応順序の決定
反応速度式は、化学反応の速度とその反応物の濃度との関係を表します。反応速度式では、反応物の濃度を変化させたときに反応速度がどのように変化するかを観察することで、速度定数kと反応次数を実験的に決定します。反応速度式を決定するための一般的な実験手法は、初期速度を用いる方法です。この方法では、異なる初期反応物濃度を用いて実施された複数の実験の反応速度を測定します。これらの実験で測定された反応速度を比較することで、反応次数とそれに続く速度定数を決定することができ、これらを組み合わせて反応速度式を求めることができます。
例えば、一酸化窒素とオゾンを含む反応[NO(g) + O3 (g) ⟶ NO2 (g) + O2 (g)]の速度は、実験室での初期速度の測定法 の実験データから求めることができます。
| Trial | [NO] (mol/L) | [O3] (mol/L) | Δ[NO2]/Δt (mol/L·s) |
| 1 | 1.00 × 10−6 | 3.00 × 10−6 | 6.60 × 10−5 |
| 2 | 1.00 × 10−6 | 6.00 × 10−6 | 1.32 × 10−4 |
| 3 | 1.00 × 10−6 | 9.00 × 10−6 | 1.98 × 10−4 |
| 4 | 2.00 × 10−6 | 9.00 × 10−6 | 3.96 × 10−4 |
| 5 | 3.00 × 10−6 | 9.00 × 10−6 | 5.94 × 10−4 |
この速度データから、一般的な速度則(rate = k[NO]m[O3]n)が定式化されます。反応次数mとnの値、および速度定数kの値は、3つの部分からなるプロセスを用いて実験データから決定されます。
ステップ1: [NO]が変化し、[O3]が一定であるデータからmの値を決定します。試行3, 4, 5では、[NO]は変化し、[O3]は一定です。試行3から4で[NO]が2倍になると速度は2倍になり、試行3から5で[NO]が3倍になると速度も3倍になります。このように、速度は[NO]にも正比例し、速度則のmは1になります。
ステップ2: [O3]を変化させ、[NO]を一定にしたデータからnの値を決定します。試行1,2,3では、[NO]は一定で、[O3]が変化します。反応速度は[O3]の変化に正比例して変化します。試行1から試行2で[O3]が2倍になると、速度は2倍になり、試行1から試行3で[O3]が3倍になると、速度の増加も3倍になります。したがって、速度は[O3]に正比例し、nは1になります。反応速度式は次のようになります。 rate = k [NO]1 [O3]1 = k [NO][O3]
ステップ3: 1セットの濃度(例えば、試行1のデータ)とそれに対応する反応速度からkの値を決定します。
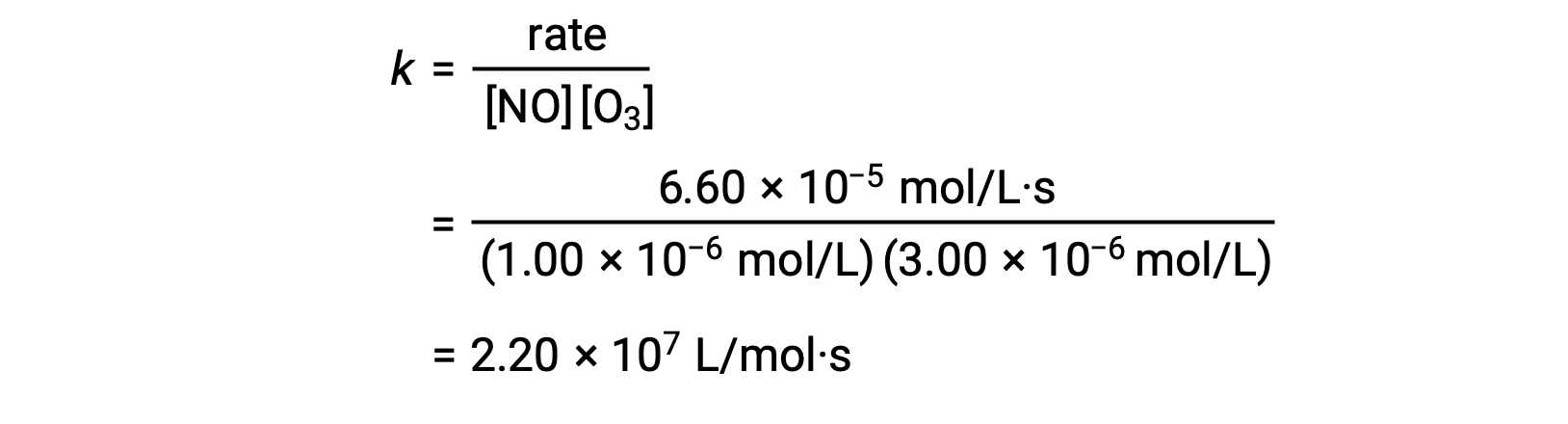
初期速度法のデータが、初期濃度と初期速度の関係を直接示唆しない反応では、反応速度式の比を含む計算を用いて、反応次数と速度定数を算出することができます。
例えば、次のような反応の速度式は右記のように表すことが出来ます。 2 NO (g) + Cl2 (g) ⟶ 2 NOCl (g): rate = k [NO]m[Cl2]n.
The data from the method of initial rates are:
| Trial | [NO] (mol/L) | [Cl2] (mol/L) | Initial Rate (mol/L·s) |
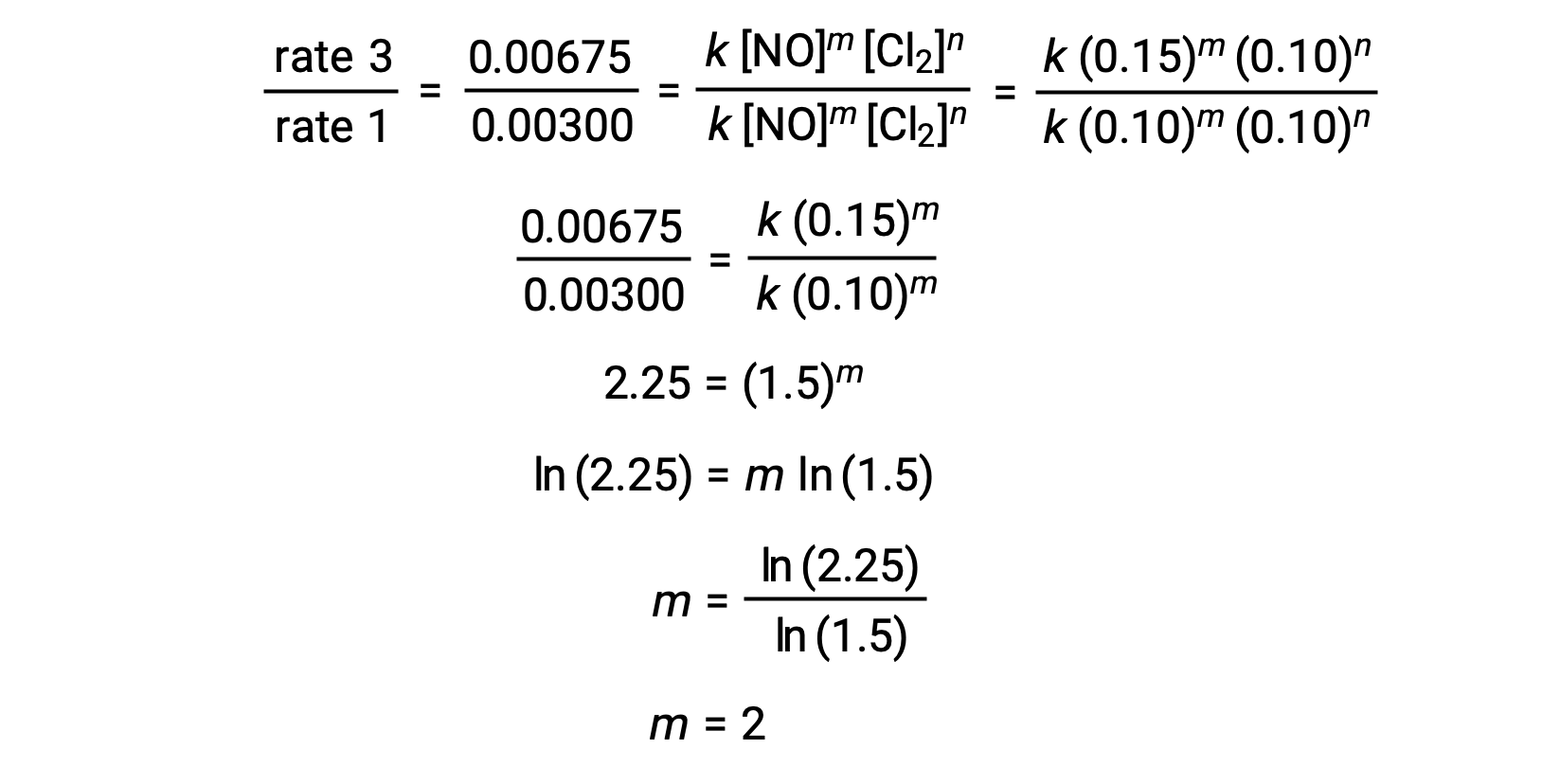
| 1 | 0.10 | 0.10 | 0.00300 |
| 2 | 0.10 | 0.15 | 0.00450 |
| 3 | 0.15 | 0.10 | 0.00675 |
実験データからmとnの値を代数的なアプローチで求め、それに続いてkの値を決定することができます。
ステップ1: [NO]が変化し、[Cl2]が一定であるデータからmの値を決定します。2つの異なる試行(例えば試行3と試行1)のデータを代入することで、速度則の比を表します。
ステップ2: [Cl2]が変化し、[NO]が一定であるデータからnの値を決定します。
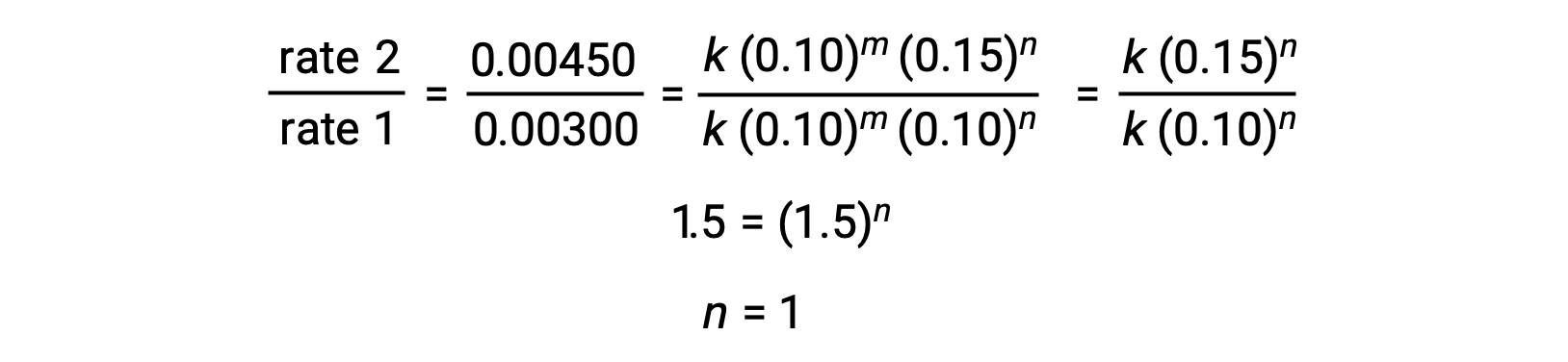
計算されたmとnの値を用いて、反応速度式は、rate = k [NO]2 [Cl2]と表されます。
ステップ3: 速度定数kの数値を適切な単位で決定します。反応の速度の単位はmol/L·sです。kの単位は、速度則の他のすべてのパラメータの単位を代入することで求められます。この例では、濃度の単位はmol3/L3です。kの単位はL2/mol2·sとし、速度がmol/L·sの単位になるようにします。kの値は、速度則の式を解いた後、任意の実験試行(例えば試行1)の値を代入するだけで決定されます。
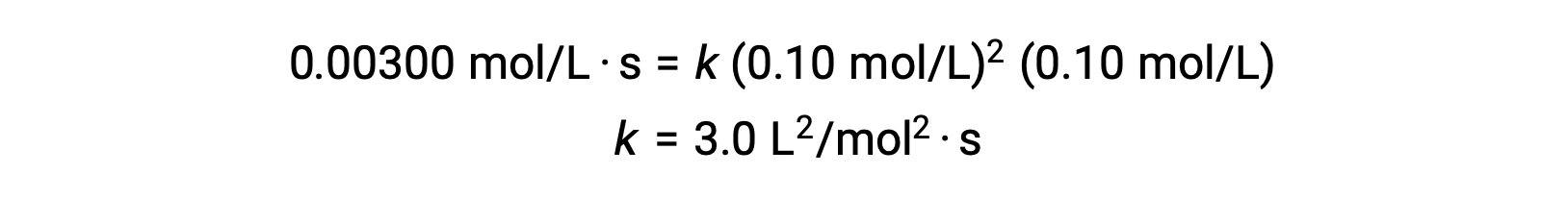
反応次数と速度定数の単位
一部の反応では、反応速度式の反応次数が、たまたまその反応の化学式の係数と同じになることがあります。これは単なる偶然であり、実際にはそうでないことが非常に多いです。また、反応速度則には、一部の反応物について分数の次数が得られることがあり、1つの反応物の濃度が増加すると反応速度が低下する場合には、負の反応次数が観察されることもあります。反応速度は実験によってのみ決定され、反応の化学量論では確実に予測できません。
速度定数の単位は、反応の全体的な順序に合わせて適宜変更します。0次反応の速度定数の単位はmol/L·s(またはM/s)、1次反応の速度定数の単位は1/sとします。2次反応の速度定数の単位はL/mol·s(または1/M·s)、3次反応の速度定数の単位はL2/mol2·sです。濃度と時間の具体的な単位は(mol/L)と(s)で示されていますが、濃度と時間の特性を表す単位は他にも有効なものがあります。
上記の文章は以下から引用しました。Openstax, Chemistry 2e, Section 12.3: Rate Laws.


