13.8: 阿伦尼乌斯图
阿伦尼乌斯方程将激活能量和率值常数 k 与化学反应相关。 在阿伦尼乌斯方程中,k = Ae−Ea/RT, R 是理想的气体常数,其值为 8.314 焦耳 / 摩尔 K ,T是开氏刻度的温度,Ea是 J/mole 中的激活能量,e是恒定·2.7183,A是一个称为频率因子的常数,这与碰撞频率和反应分子的方向有关。
阿伦尼乌斯方程可用于计算实验动能数据的反应的激活能量。 一种方便的方法来确定Ea进行反应,即在两个或多个不同温度下测量 k。 它使用方程的修改版本,其形式为线性阿伦尼乌斯方程:
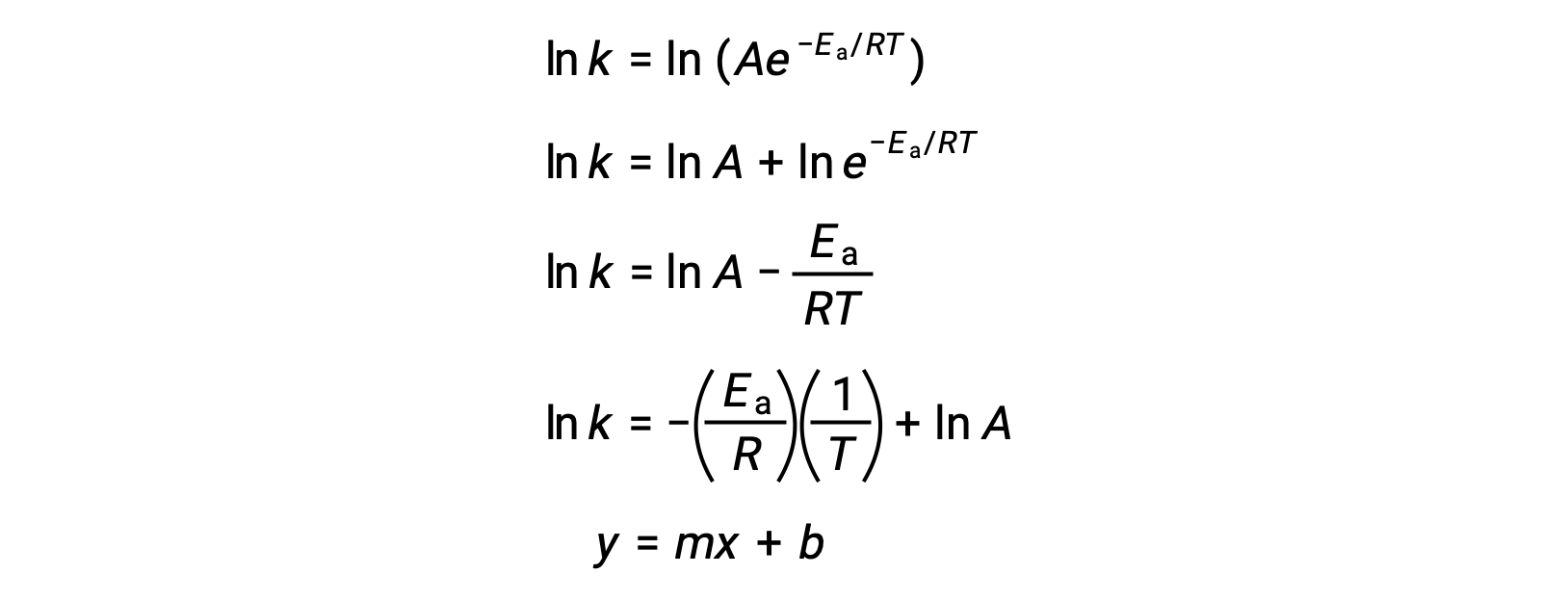
ln k与 1/T 的图解是线性的,斜率等于 −Ea/R ,y 截距等于 ln A
考虑以下反应:
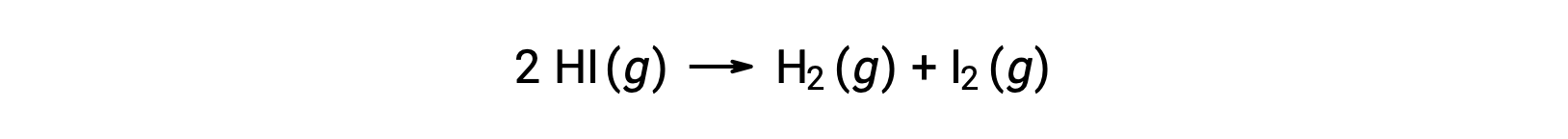
如果通过反应动能数据了解率值常数与温度的变化,则可以确定此反应的激活能量,如图所示。
| 温度 (K) | 率值常数 (L/mol/s) |
| 555 | 3.52 × 10–7 |
| 575 | 1.22 × 10–6 |
| 645 | 8.59 × 10–5 |
| 700 | 1.16 × 10–3 |
| 781 | 3.95 × 10–2 |
所提供的数据可用于导出温度的反向值 (1/T) 和 k (ln k)的自然对数。
| 1/T (K–1) | ln k |
| 1.80 × 10–3 | –14.860 |
| 1.74 × 10–3 | –13.617 |
| 1.55 × 10–3 | –9.362 |
| 1.43 × 10–3 | –6.759 |
| 1.28 × 10–3 | –3.231 |
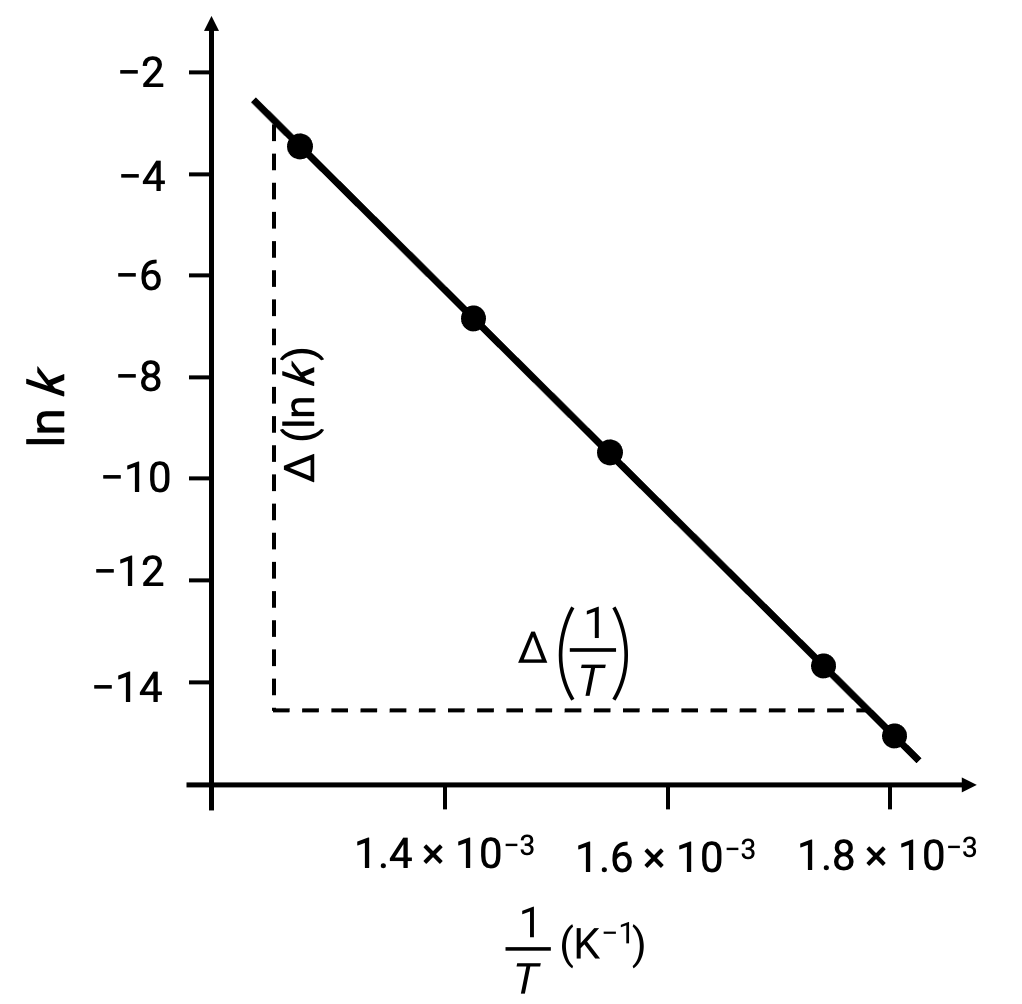
在用 ln k 与1/T 绘制派生数据点时,将生成一个线性关系图,显示 ln k与1/T之间的线性关系,如图所示。
可以使用任意两个实验数据对来估计与激活能量相对应的线路斜率。

派生激活能量的另一种方法是在两个不同的温度下使用率值常数。 通过这种方法,阿伦尼乌斯方程被重新排列为方便的两点形式:
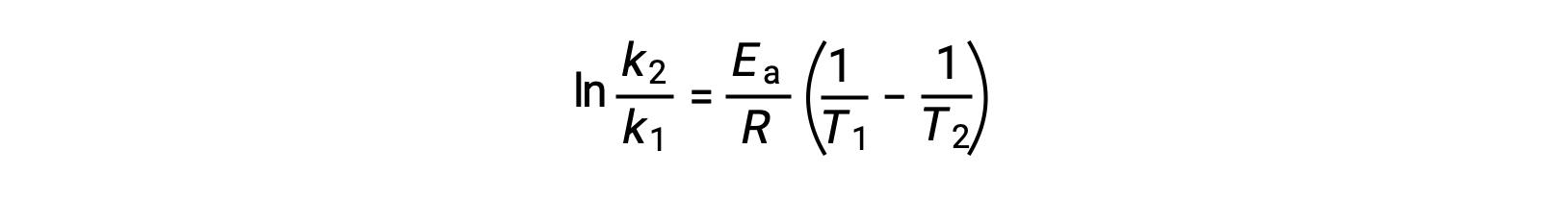
重新排列方程时,将生成激活能量的表达式。
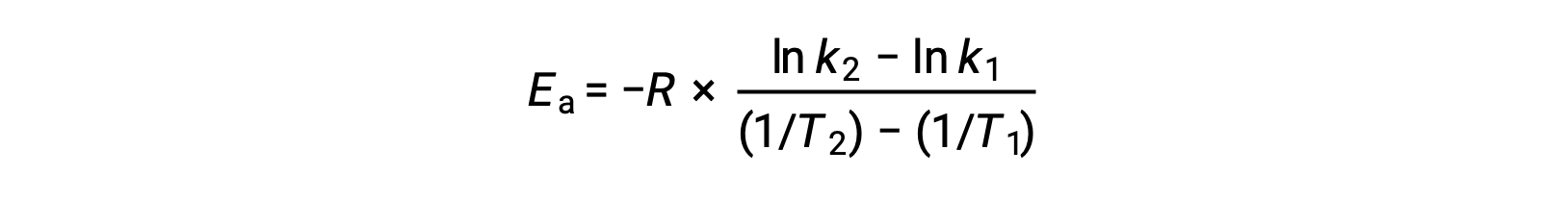
通过替换任何两个数据对并进一步计算生成激活能量的值以焦耳每摩尔或千焦耳每摩尔为单位。
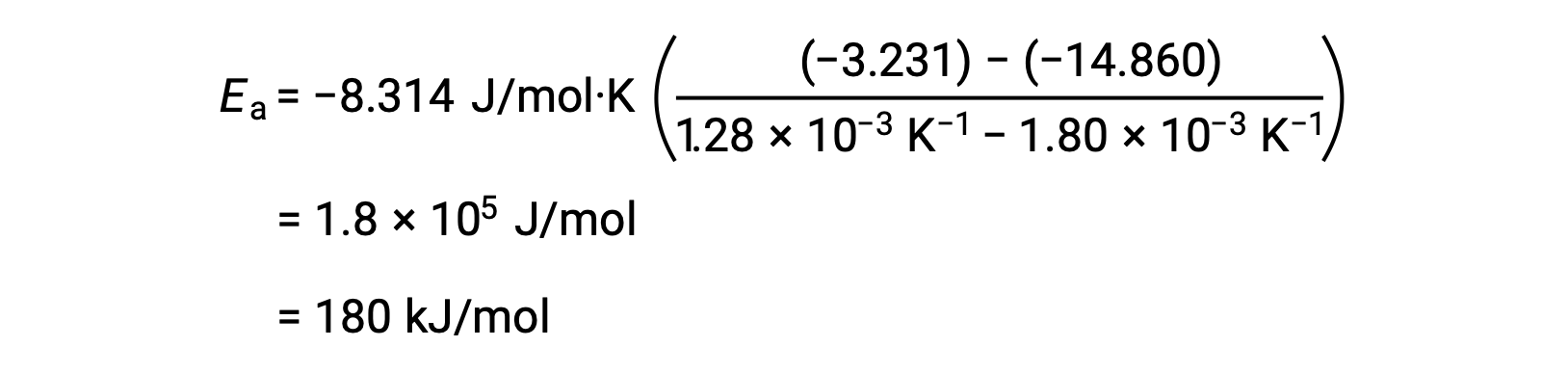
这种备选两点方法生成的结果与图形方法的结果相同。 但是,在实践中,图形方法通常在处理实际实验数据的同时提供更可靠的结果。
本文改编自 Openstax, 化学 2e, 第12.5节:碰撞理论。


