14.1: Equilíbrio Dinâmico
Uma reação química reversível representa um processo químico que prossegue tanto na direção direta (da esquerda para a direita) como inversa (da direita para a esquerda). Quando as velocidades das reações direta e inversa são iguais, as concentrações das espécies de reagentes e produtos permanecem constantes ao longo do tempo e o sistema está em equilíbrio. Uma seta dupla especial é utilizada para enfatizar a natureza reversível da reação. As concentrações relativas de reagentes e produtos em sistemas de equilíbrio variam muito; alguns sistemas contêm principalmente produtos em equilíbrio, alguns contêm principalmente reagentes, e alguns contêm quantidades apreciáveis de ambos.
Equilíbrio Dinâmico em Reações Químicas
Considere a decomposição reversível de tetróxido de dinitrogénio incolor para produzir dióxido de nitrogénio castanho, descrita pela equação:
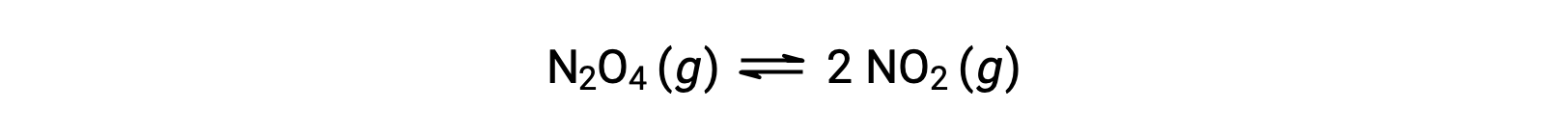
Quando a reação começa (tempo = 0), a concentração do reagente N2O4 é finita e a do produto NO2 é zero, pelo que a reação direta prossegue a uma velocidade finita enquanto que a velocidade da reação inversa é zero. À medida que o tempo passa, o N2O4 é consumido e a sua concentração diminui, enquanto que o NO2 é produzido, e a sua concentração aumenta. A diminuição da concentração do reagente diminui a velocidade da reação direta e a concentração crescente do produto acelera a velocidade da reação inversa. Este processo continua até que as velocidades de reação direta e inversa se tornem iguais, altura em que a reação atingiu o equilíbrio. É importante enfatizar que os equilíbrios químicos são dinâmicos; uma reação em equilíbrio não “parou”", mas está a decorrer nas direções direta e inversa à mesma velocidade. Assim, em equilíbrio, as concentrações de N2O4 e NO2 já não mudam porque a velocidade de formação de NO2 é exactamente igual à velocidade de consumo de NO2, e a velocidade de formação de N2O4 é exactamente igual à velocidade de consumo de N2O4.
Equilíbrios Homogéneos e Heterogéneos
Um equilíbrio homogéneo é aquele em que todos os reagentes e produtos (e quaisquer catalisadores, se aplicável) estão presentes na mesma fase, quer na fase aquosa quer na fase gasosa, como ilustrado nos seguintes exemplos:
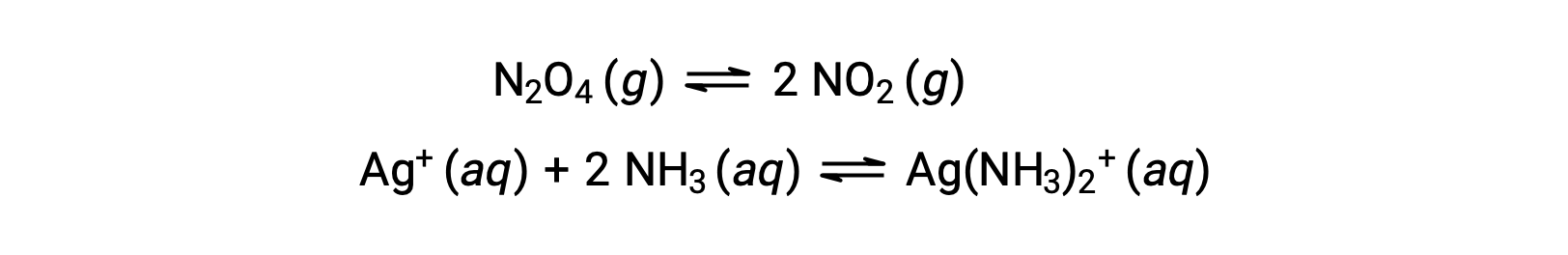
Um equilíbrio heterogéneo envolve reagentes e produtos em duas ou mais fases diferentes, como ilustrado pelo exemplo a seguir:
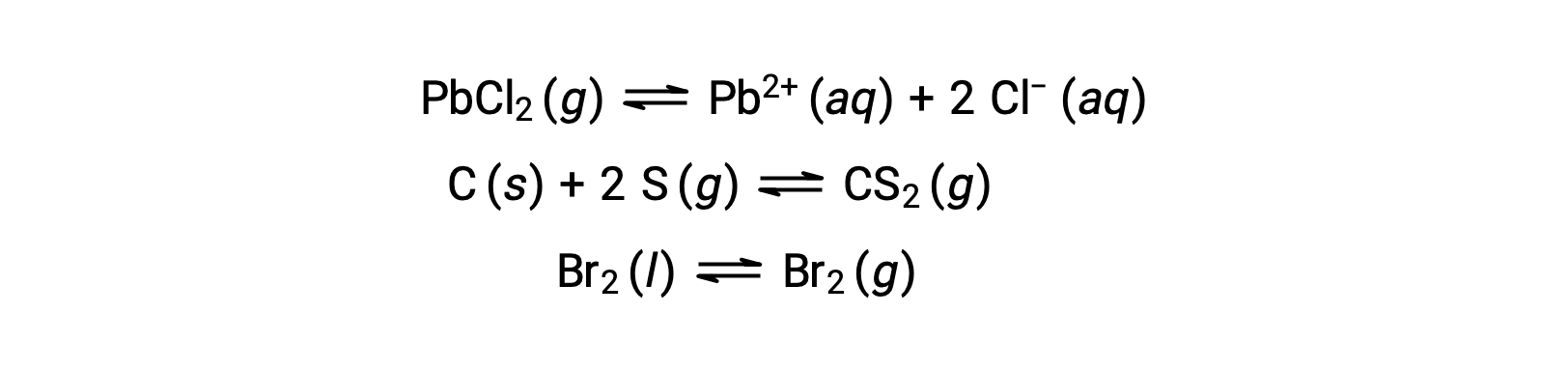
Este texto foi adaptado de Openstax, Chemistry 2e, Section 13.1 Chemical Equilibria.


