14.3: Equilíbrio para Reações Gasosas e Reações Heterogéneas
Equilíbrios Homogéneos para Reações Gasosas
Para reações de fase gasosa, a constante de equilíbrio pode ser expressa em termos de concentrações molares (Kc) ou de pressões parciais (Kp) dos reagentes e produtos. Uma relação entre esses dois valores de K pode ser simplesmente derivada da equação de gás ideal e da definição de molaridade. De acordo com a equação de gás ideal:
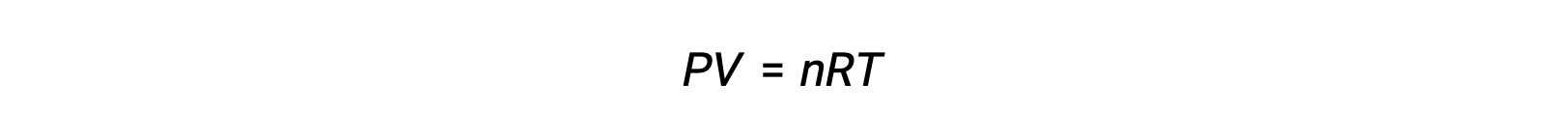
A concentração molar ou molaridade é dada pelo número de moles dividido pelo volume:
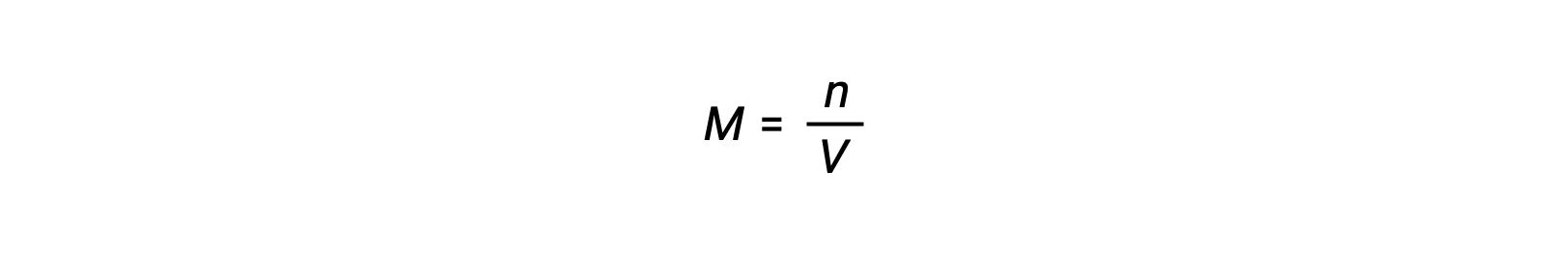
Assim,
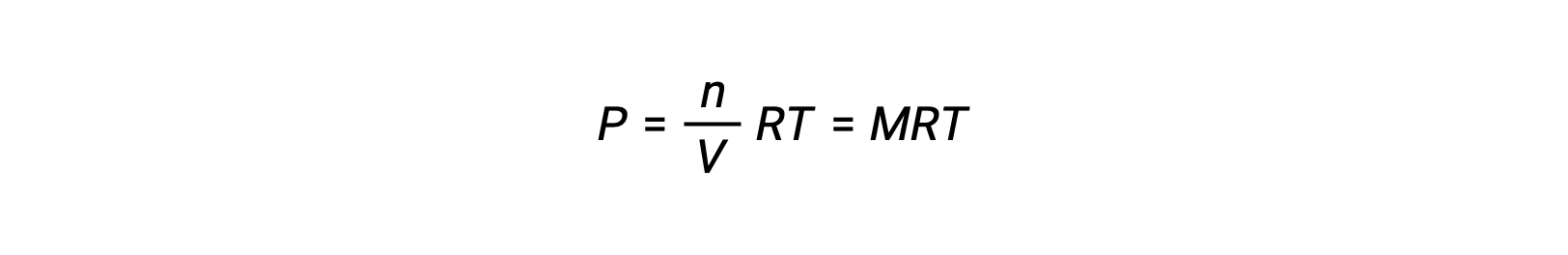
onde P é pressão parcial, V é volume, n é número de moles, R é a constante de gás, T é temperatura, e M é concentração molar.
Para a reação de fase gasosa: m A + n B ⇌ x C + y D
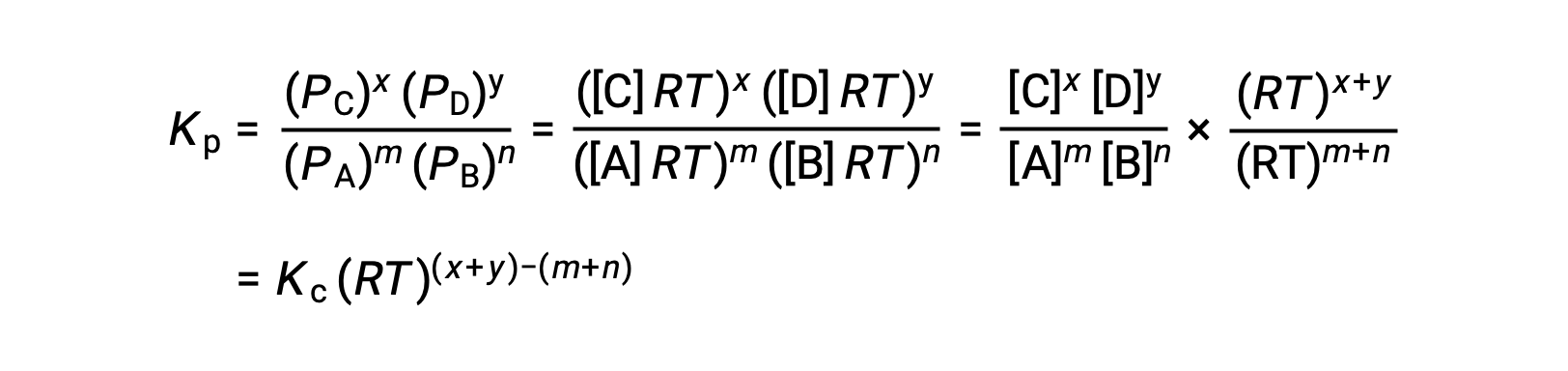
E assim, a relação entre Kc e KP é
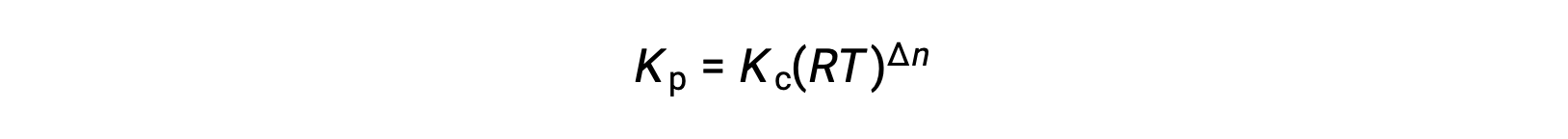
onde Δn é a diferença entre as quantidades molares de gases de produtos e reagentes, neste caso:
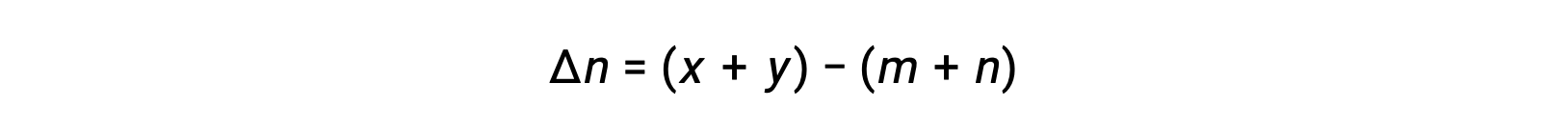
Este texto foi adaptado de Openstax, Chemistry 2e, Section 13.2 Equilibrium Constants.


