14.5: 反応商
可逆反応の状態は、その反応商(Q)を評価することで簡単に知ることができます。m A + n B ⇌ x C + y D で記述される可逆反応の場合、反応商は平衡式の化学量論から次のように直接導かれます。
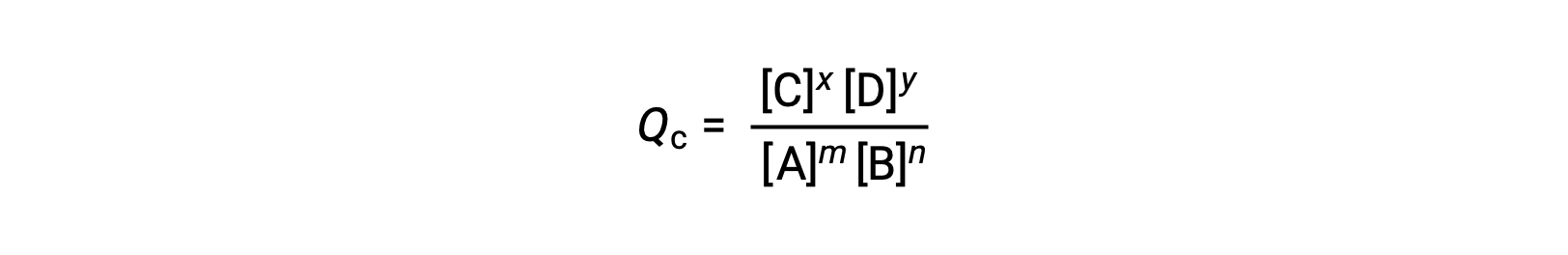
ここで、添え字のcは、式の中でモル濃度を使用していることを示します。反応物と生成物が気体の場合は、分圧を用いて同様に反応商を求めることができます。
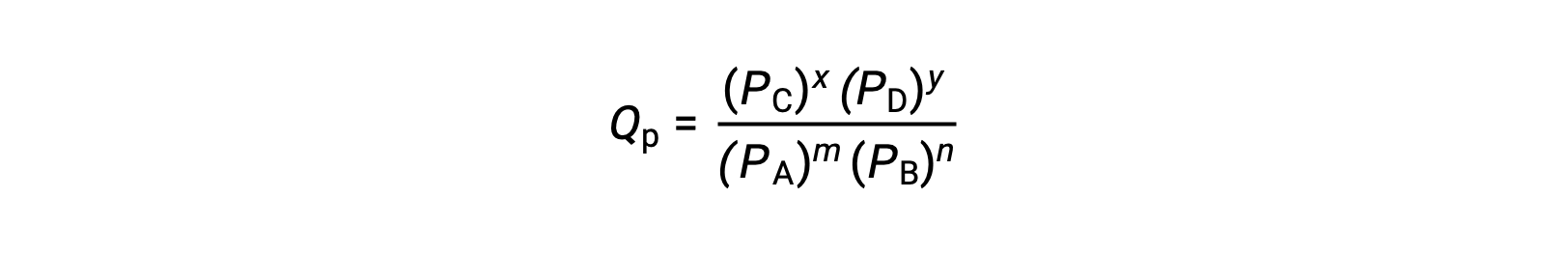
上の反応商の式は、濃度や圧力に絶対値ではなく相対値を用いる、より厳密な式を単純化したものであることに注意しましょう。これらの相対的な濃度と圧力の値は無次元(無単位)であり、その結果、反応商も無次元となります。
Qの値は、反応が平衡に近づくにつれて変化するため、反応の状態を示す指標として有効です。ここでは、二酸化硫黄の酸化反応について考えます。
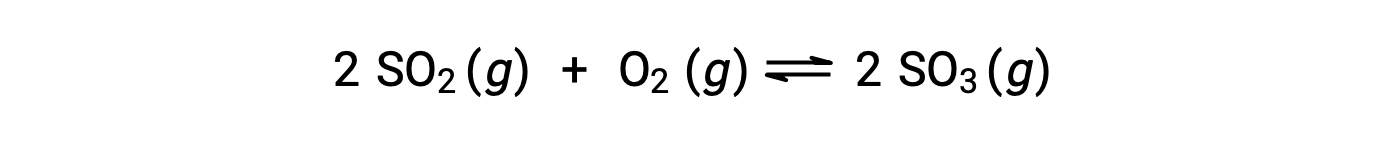
ここでは、この反応を反応物であるSO2とO2のみの混合物で開始する場合と、生成物であるSO3のみで開始する場合の2つの異なる実験が考えられます。反応物のみの混合物で始まる反応では、Qは最初ゼロに等しいです。
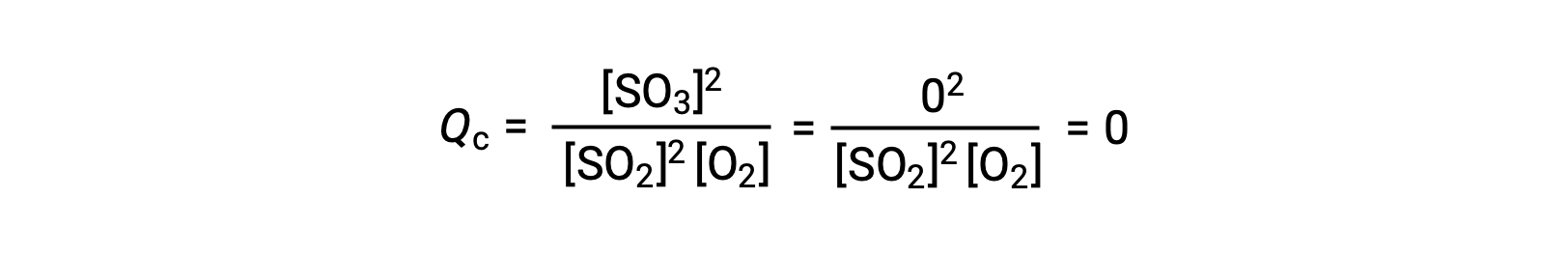
反応が順方向に平衡に向かって進むと、反応物の濃度は減少する(Qcの分母も同様である)。そして生成物の濃度は増加し(Qcの分子も同様である)、結果的に反応商は増加します。平衡が達成されると、反応物と生成物の濃度は一定になり、Qcの値も一定になります。
生成物のみが存在する状態で反応が始まると、Qcの値は最初は無限大となります。
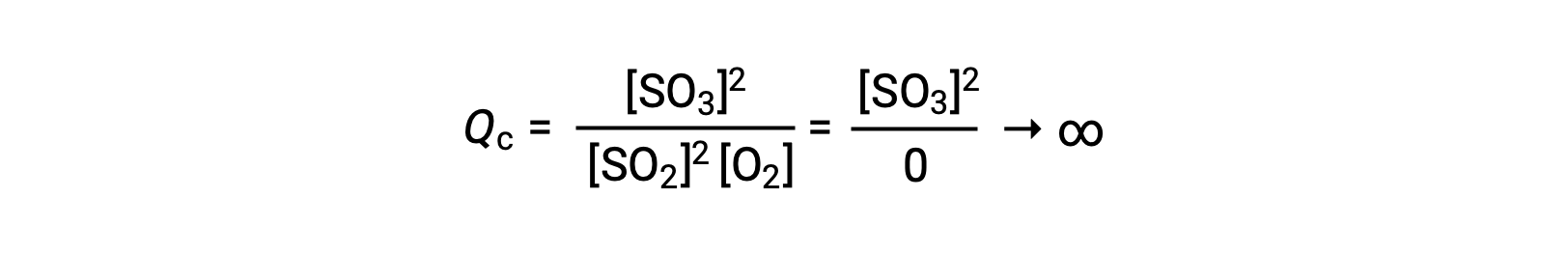
この場合、反応は逆方向に平衡へと向かって進む。生成物の濃度とQcの分子は時間とともに減少し、反応物の濃度とQcの分母は増加します。その結果、反応商は平衡状態で一定になるまで減少します。このように平衡状態にある系が示すQの一定値を平衡定数Kといいます。
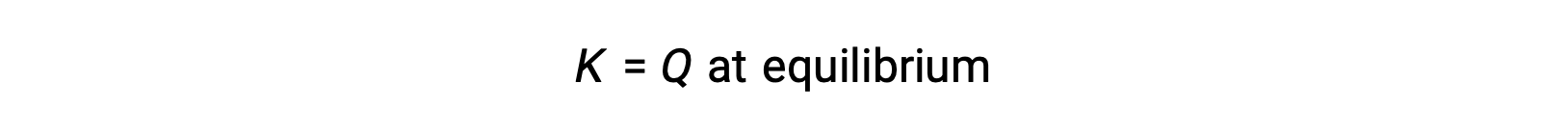
反応商の評価
気体状の二酸化窒素は、次式によって四酸化二窒素を形成します。
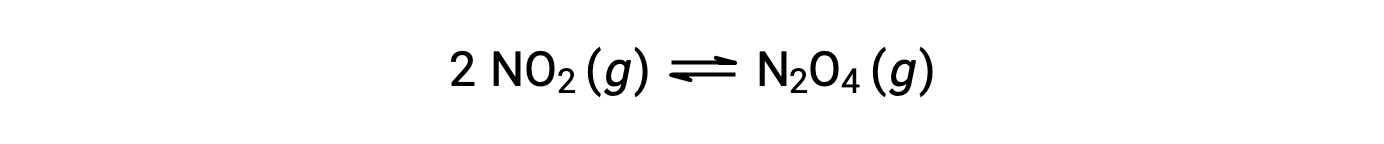
25°Cの1.0 Lのフラスコに0.10 molのNO2を加えると、その濃度が変化します。平衡状態では[NO2] = 0.016 M、[N2O4] = 0.042 Mとなります。 生成物が生成する前の状態では、[NO2] = 0.10 M、[N2O4] = 0 Mです。
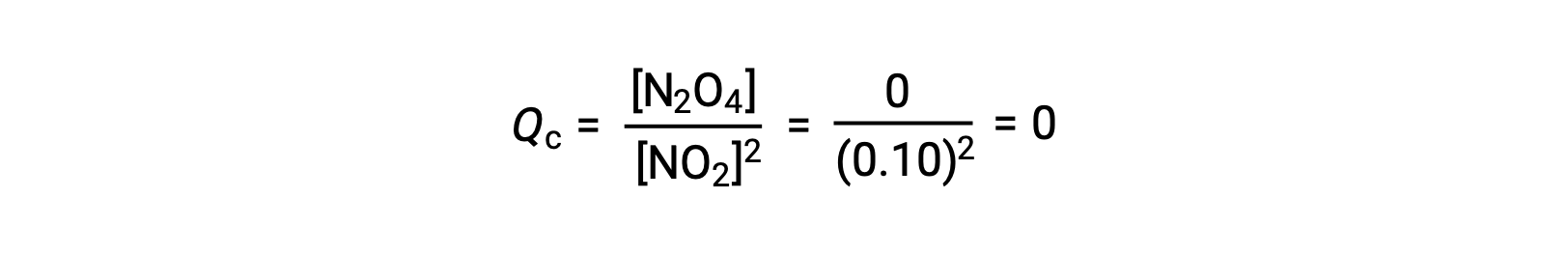
平衡状態において、
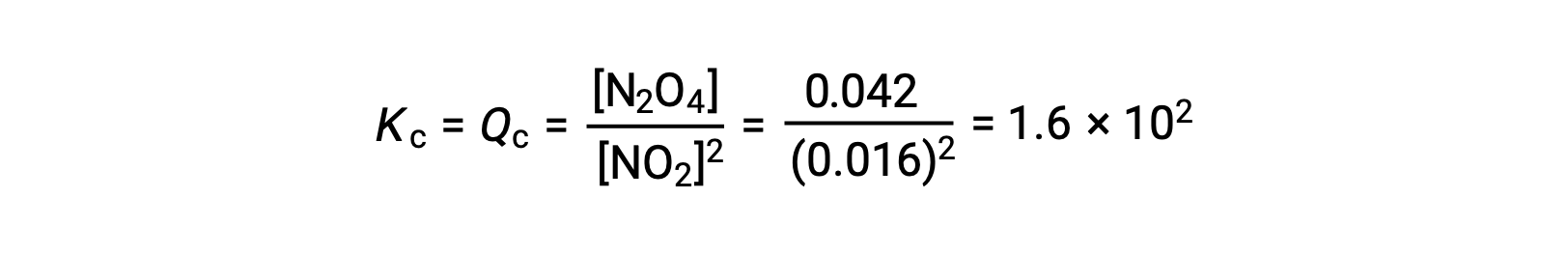
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 13.2 Equilibrium Constants.


