14.8: O Princípio de Le Chatelier: Alteração da Concentração
Um sistema em equilíbrio encontra-se em um estado de equilíbrio dinâmico, com as reações direta e inversa a velocidades iguais. Se um sistema de equilíbrio for sujeito a uma mudança de condições que afete estas velocidades de reação de forma diferente (um stress), então as velocidades não são mais iguais e o sistema não está em equilíbrio. O sistema irá, subsequentemente, sofrer uma reação líquida na direção de uma velocidade superior (uma alteração) que restabelecerá o equilíbrio. Este fenómeno é resumido pelo princípio de Le Châtelier: Se um sistema de equilíbrio for sujeito a um stress, o sistema irá sofrer uma mudança em resposta ao stress que restabelece o equilíbrio.
As velocidades de reação são afetadas principalmente por concentrações, conforme descrito pela lei de velocidade de reação, e temperatura, conforme descrito pela equação de Arrhenius. Consequentemente, as mudanças na concentração e na temperatura são os dois stresses que podem deslocar um equilíbrio.
Efeito de uma Alteração na Concentração
Se um sistema de equilíbrio for sujeito a uma alteração na concentração de uma espécie de reagente ou de produto, a velocidade da reação direta ou inversa será alterada. Como exemplo, considere a reação de equilíbrio:

Quando este sistema está em equilíbrio, as velocidades de reação direta e inversa são iguais.
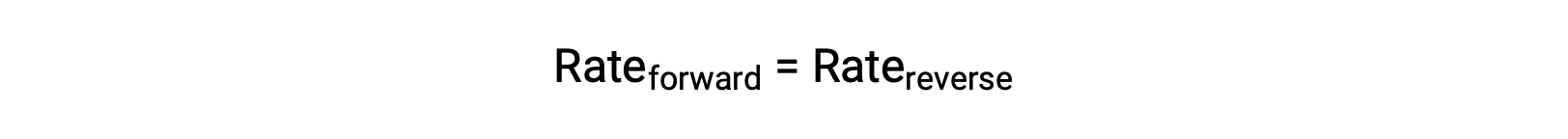
Se o sistema for stressado pela adição de reagentes, quer N2 quer O2, o aumento resultante da concentração provoca o aumento da velocidade de reação direta, ultrapassando a da reação inversa:

O sistema irá experienciar uma reação direta líquida temporária para restabelecer o equilíbrio (o equilíbrio irá mudar para a direita). Esta mesma alteração irá resultar se algum produto NO for removido do sistema, o que diminui a velocidade da reação inversa, novamente resultando no mesmo desequilíbrio nas velocidades.
A mesma lógica pode ser usada para explicar a mudança para a esquerda que resulta da remoção de reagente ou da adição de produto a um sistema de equilíbrio. Ambos estes stresses resultam em uma velocidade aumentada para a reação inversa

e uma reação inversa líquida temporária para restabelecer o equilíbrio.
Como alternativa a esta interpretação cinética, o efeito de alterações na concentração sobre os equilíbrios pode ser racionalizado em termos de quocientes de reação. Quando o sistema está em equilíbrio,
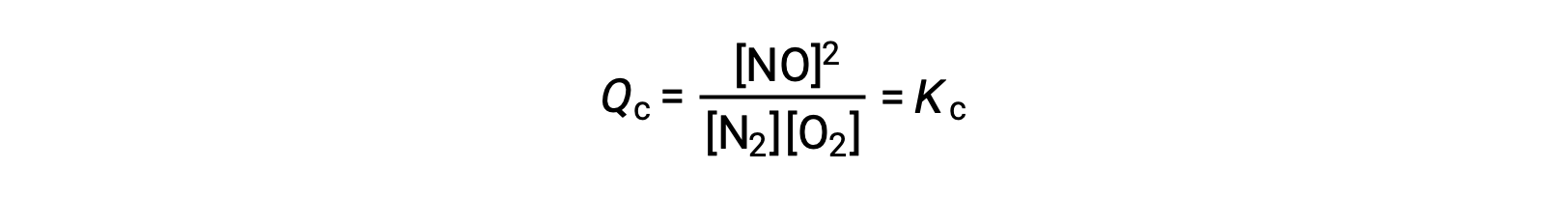
Se for adicionado um reagente (aumentando o denominador do quociente de reação) ou se for removido produto (diminuindo o numerador) então Qc < Kc e o equilíbrio irá mudar para a direita. Note-se que as três formas diferentes de induzir este stress resultam em três mudanças diferentes na composição da mistura de equilíbrio. Se for adicionado N2, o desvio para a direita irá consumir O2 e produzir NO à medida que o equilíbrio é restabelecido, produzindo uma mistura com uma maior concentração de N2 e NO e uma menor concentração de O2 do que a que estava presente anteriormente. Se for adicionado O2, a nova mistura de equilíbrio terá maiores concentrações de O2 e NO e menor concentração de N2. Por fim, se for removido NO, a nova mistura de equilíbrio terá maiores concentrações de N2 e O2 e menor concentração de NO. Apesar dessas diferenças na composição, o valor da constante de equilíbrio após o stress será o mesmo que antes (de acordo com a lei da ação das massas). A mesma lógica pode ser aplicada para stresses que envolvam a remoção de reagentes ou adição de produto, caso em que Qc > Kc e o equilíbrio se deslocará para a esquerda.
Este texto foi adaptado de Openstax, Chemistry 2e, Section 13.3 Shifting Equilibria: LeChatelier’s Principle.


