14.8: 勒夏特列原理(Le Chatelier's Principle) :浓度变化
平衡系统处于动态平衡状态,正向和反向反应以相等的速率发生。 如果平衡系统的条件发生变化,对这些反应速度的影响也不同 (应力) ,则速度不再相等,系统也不处于平衡状态。 该系统随后将在更大的率值 (换档) 方向发生净反应,该转换将重新建立平衡。 勒夏特列原理(LeChatelier's Principle)概括了这一现象:如果强调平衡系统,该系统将经历一场转变,以应对重新建立平衡的压力。
反应速率主要受到反应的速率定律所述的浓度和阿伦尼乌斯方程所述的温度的影响。 因此,浓度和温度的变化是可以改变平衡的两个应力。
浓度更改的影响
如果平衡系统受到反应物或生成物物种浓度变化的影响,正向或反向反应的率值将发生变化。 以平衡反应为例:

当该系统处于平衡状态时,正向和反向反应速率相等。
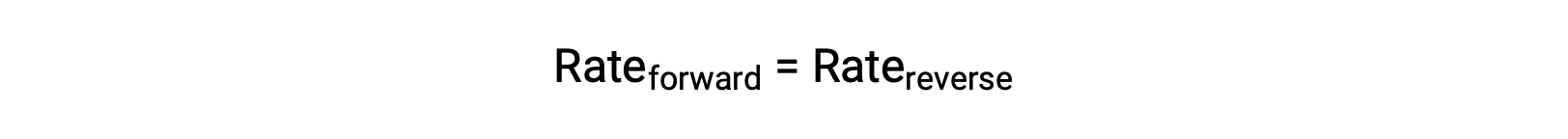
如果通过添加氮气或氧气来对系统进行压力,则浓度的增加会导致正向反应的率值增加,超过反向反应的反应物:

该系统将在前进方向发生临时净反应,以重新建立平衡 (平衡将向右转移)。 如果系统中的某些生成物 NO 被移除,则会产生相同的偏移,这会降低反向反应的率值,再次导致速率失衡。
同样的逻辑也可用于解释从删除反应物或将生成物添加到平衡系统中所产生的左移。 这两种应力都会导致反向反应的率值增加

以及反向的临时净反应,以重新建立平衡。
作为这种动力学解释的替代方法,浓度变化对平衡的影响可以从反应商的角度加以合理化。 当系统处于平衡状态时,
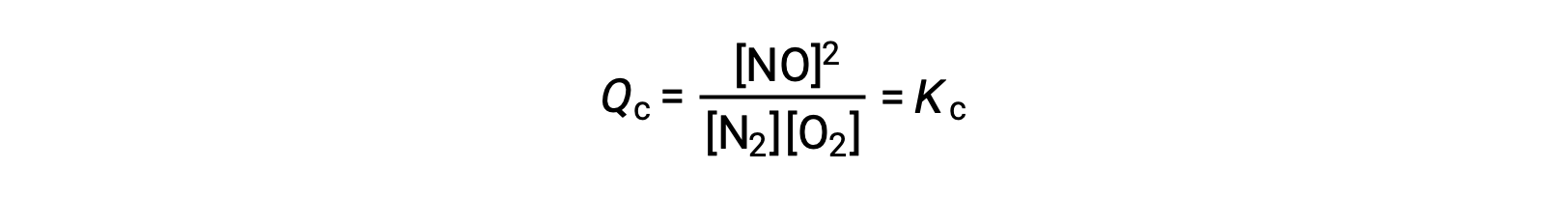
如果添加了反应物 (增加反应商的分母) 或删除了生成物 (减少分子) ,则 QC < KC 和平衡将向右移动。 请注意,诱发这种压力的三种不同方式会导致平衡混合物的组成发生三种不同的变化。 如果添加 N2 ,则右移将消耗 O2 ,并在重新建立平衡时产生 NO ,产生的混合物中 N2的浓度越大, O2 的浓度越少,越少。 如果添加了 O2 ,新的平衡混合物的 O2 浓度将更高, NO 浓度将更低,浓度 N2 浓度将更低。 最后,如果不去除,新的平衡混合物的氮气和氧气浓度将会更高,浓度值将会更低。 尽管成分存在这些差异,但平衡常数的值在应力结束后将与以前相同 (根据质量作用定律)。 对于涉及移除反应物或添加生成物的应力,也可以应用相同的逻辑,在这种情况下Qc > KC 平衡将向左移动。
本文改编自 Openstax, 化学 2e, 第13.3节: 平衡位移:勒夏特列原理(LeChatelier's Principle)。


