14.9: مبدأ لوشاتيليير: تغيير الحجم (الضغط)
بالنسبة لتوازن الطور الغازي، يمكن أن تحدث تغيرات في تركيزات المواد المتفاعلة والمنتجات مع تغير الحجم والضغط. ويتناسب الضغط الجزئي، P, للغاز المثالي مع تركيزه المولي، M.
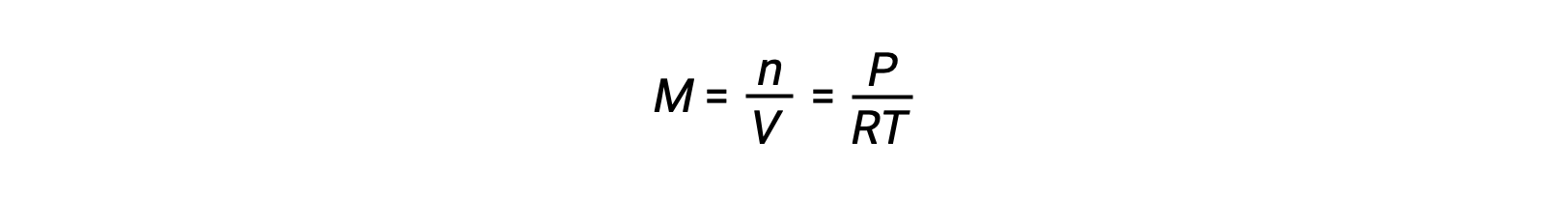
لذا فإن التغييرات في الضغوط الجزئية لأي مادة متفاعلة أو منتج هي في الأساس تغيرات في التركيزات؛ لذلك، فإن هذه التغييرات تنتج نفس التأثيرات على التوازن. بصرف النظر عن إضافة أو إزالة المواد المتفاعلة أو المنتجات، يمكن أيضًا تغيير ضغوط (تركيزات) الأنواع في توازن الطور الغازي عن طريق تغيير الحجم الذي يشغله النظام. نظرًا لأن جميع أنواع توازن الطور الغازي تشغل نفس الحجم، فإن تغييرًا معينًا في الحجم سيؤدي إلى نفس التغيير في التركيز لكل من المواد المتفاعلة والمنتجات. من أجل تمييز التحول، إن وجد، الذي سيحدثه هذا النوع من الإجهاد ، يجب مراعاة قياس العناصر المتفاعلة في التفاعل.
عند التوازن ، التفاعل N2 (g) + O2 (g) ⇌ 2 NO (g) موصوفة في حاصل قسمة التفاعل
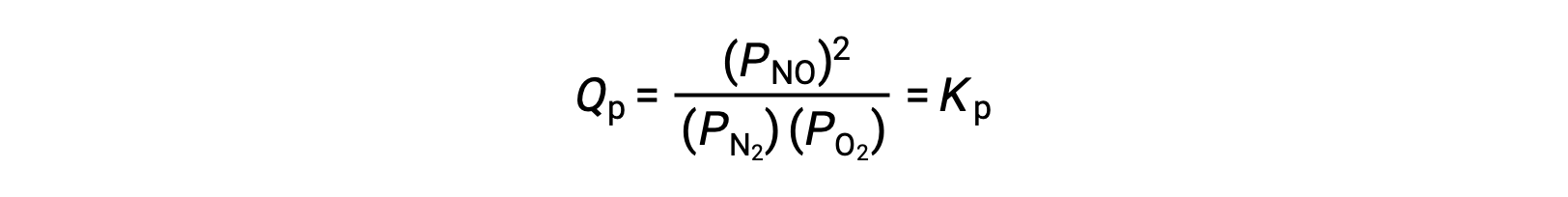
إذا انخفض الحجم الذي يشغله خليط التوازن لهذه الأنواع بمعامل 3 ، فإن الضغوط الجزئية لجميع الأنواع الثلاثة ستزداد بمعامل 3:
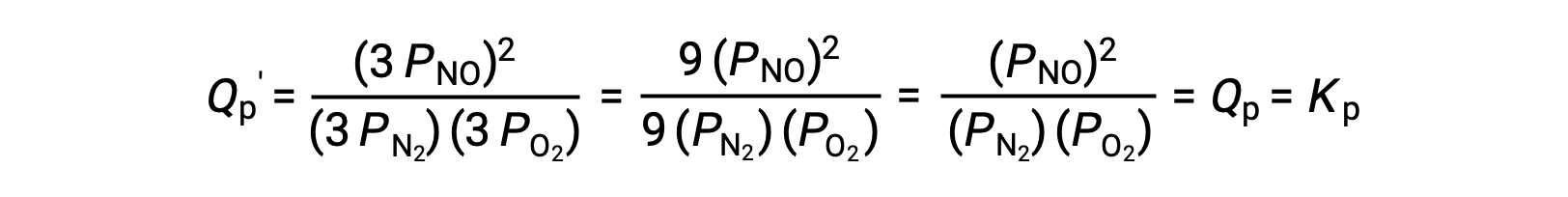
وهكذا، فإن تغيير حجم خليط توازن الطور الغازي لا يؤدي إلى حدوث تحول في التوازن.
معاملة مماثلة لنظام مختلف، 2 SO2 (g) + O2 (g) ⇌ 2 SO3 (g) بكل الأحوال، ينتج عنها عن نتيجة مختلفة:
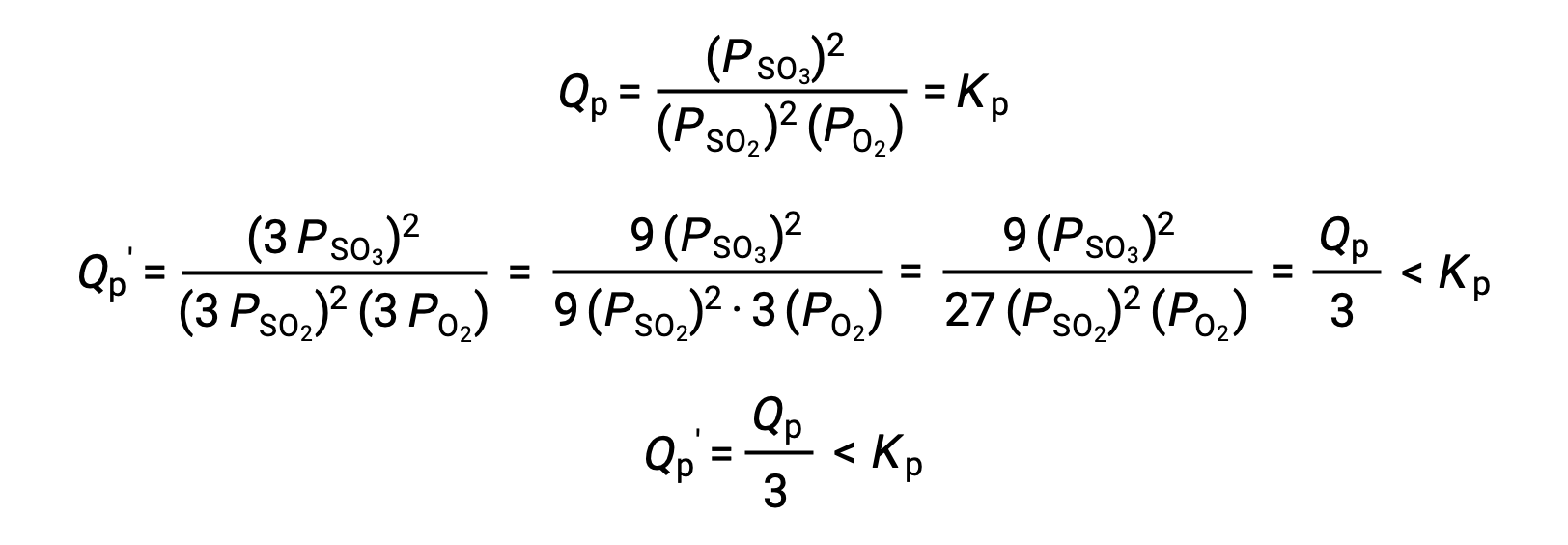
في هذه الحالة، ينتج عن التغيير في الحجم حاصل قسمة التفاعل أصغر من ثابت التوازن، وبالتالي فإن التوازن سوف يتحول إلى اليمين.
توضح هذه النتائج العلاقة بين القياس المتكافئ لتوازن الطور الغازي وتأثير تغيير الضغط (التركيز) الناجم عن الحجم. إذا كانت الكميات المولية الإجمالية للمواد المتفاعلة والمنتجات متساوية ، كما في المثال الأول ، فإن التغيير في الحجم لا يغير التوازن. إذا كانت الكميات المولية للمواد المتفاعلة والنواتج مختلفة ، فإن التغيير في الحجم سيغير التوازن في اتجاه أفضل “يستوعب” تغيير الحجم. في المثال الثاني، ثلاثة مولات من المادة المتفاعلة (SO2 و O2) تنتج مولات من المنتج (SO3) ، وبالتالي تناقص يتسبب حجم النظام في تحول التوازن إلى اليمين لأن التفاعل الأمامي ينتج غازًا أقل (2 مول) من التفاعل العكسي (3 مول). على العكس من ذلك، فإن زيادة حجم نظام التوازن هذا سيؤدي إلى تحول نحو المواد المتفاعلة.
تم اقتباس هذا النص من Openstax, Chemistry 2e, Section 13.3 Shifting Equilibria: LeChatelier’s Principle.


