15.3: 水:ブレンステッド・ローリーの酸塩基理論
BrøNsted-Lowry酸と水との反応を酸のイオン化といいます。例えば、フッ化水素が水に溶けて電離すると、フッ化水素分子から水分子にプロトンが移動し、ヒドロニウムイオンとフッ化物イオンが生成します。
ある化学種が水分子からプロトンを受け取ると塩基性のイオン化が起こります。下の例では、ピリジン分子(C5NH5)が水に溶けると塩基性のイオン化を起こし、水酸化物イオンとピリジニウムイオンが生成します。
前述のイオン化反応は、水が塩基(フッ化水素との反応のように)としても酸(アンモニアとの反応のように)としても作用することを示しています。プロトンを供与することも受容することもできる種は、両性物質と呼ばれます。以下の式は、両性物質である炭酸水素イオンと水の2通りの可能な酸-塩基反応を示しています。
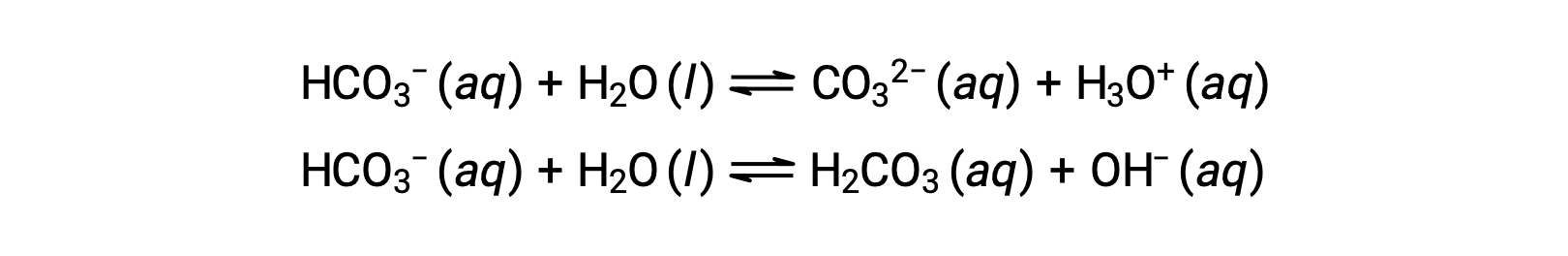
1つ目の式は、酸としての炭酸水素塩と塩基としての水との反応を表し、2つ目の式は、塩基としての炭酸水素塩と酸としての水との反応を表しています。炭酸水素塩を水に加えると、これらの平衡が同時に成立するため、それぞれの平衡を加味して最終的な溶液の組成が決まります。液体状態における両性物質の分子は、以下の式で水について示されているように、互いに反応することができます。
同種の分子が反応してイオンを生成する過程を自己解離といいます。液体の水の自己解離はごくわずかで、25 °Cでは10億個の水分子のうち約2個がイオン化しています。水の自己解離の程度は、その平衡定数である水のイオン積KWの値に反映されます。
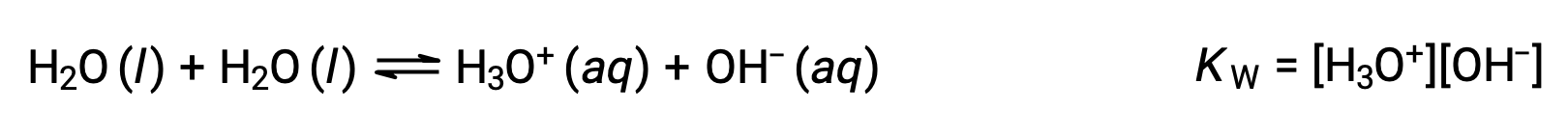
純水のわずかな電離は平衡定数の小さな値に反映され、25°CではKWは1.0 × 10−14の値を示します。
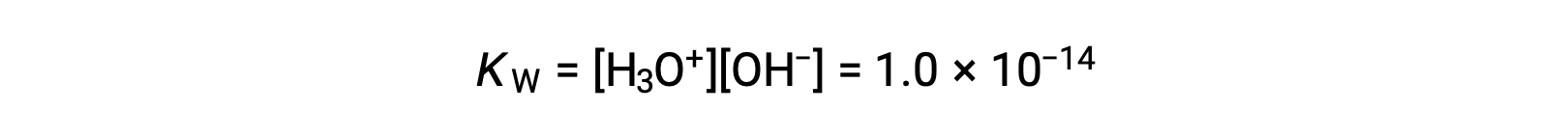
これは吸熱反応であるため、電離の程度とその結果としてのヒドロニウムイオンと水酸化物イオンの濃度は温度とともに増加します。例えば、100 °Cの場合、KWの値は約5.6 × 10−13となり、25 °Cの場合に比べて約50倍になります。
水の自己解離では、ヒドロニウムイオンと水酸化物イオンが同じ数だけ生成します。したがって、25 °Cの純水では、
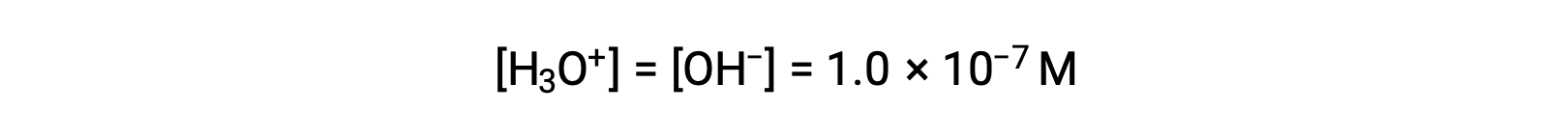
溶液中のこれらのイオンの濃度は、その溶液の性質や他の溶質の化学的挙動を決定する重要な要素であることが多く、これらの濃度を相対的に表現するための語句が定義されています。ヒドロニウムイオンと水酸化物イオンの濃度が同じであれば中性、ヒドロニウムイオンの濃度が水酸化物イオンよりも高ければ酸性、ヒドロニウムイオンの濃度が水酸化物イオンよりも低ければ塩基性となります。
酸性、塩基性、中性溶液の関係のまとめ
| 分類 | 相対的なイオン濃度 | 25 °CでのpH |
| 酸性 | [H3O+] > [OH−] | pH < 7 |
| 中性 | [H3O+] = [OH−] | pH = 7 |
| 塩基性 | [H3O+] < [OH−] | pH > 7 |
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 14.1: Brønsted-Lowry Acids and Bases, andSection 14.2: pH and pOH.


