15.3: L'eau : un acide et une base selon Bronsted-Lowry
La réaction entre un acide de Brønsted-Lowry et l'eau est appelée une ionisation de l'acide. Par exemple, lorsque le fluorure d'hydrogène se dissout dans l'eau et s'ionise, les protons sont transférés des molécules de fluorure d'hydrogène aux molécules d'eau, ce qui donne des ions hydronium et des ions fluorure :
L'ionisation de la base d'une espèce se produit lorsqu'elle accepte des protons provenant de molécules d'eau. Dans l'exemple ci-dessous, les molécules de pyridine, C5NH5, subissent l'ionisation de la base lorsqu'elles sont dissoutes dans l'eau, produisant des ions d'hydroxyde et pyridinium :
Les réactions d'ionisation précédentes suggèrent que l'eau peut fonctionner à la fois comme une base (comme dans sa réaction avec le fluorure d'hydrogène) et comme un acide (comme dans sa réaction avec l'ammoniac). On dit que les espèces capables de donner ou d'accepter des protons sont amphiprotiques, ou plus généralement, amphotères, un terme qui peut être utilisé pour les acides et les bases selon des définitions autres que celle de Brønsted-Lowry. Les équations ci-dessous montrent les deux réactions acido-basiques possibles pour deux espèces amphiprotiques, l'ion bicarbonate et l'eau :
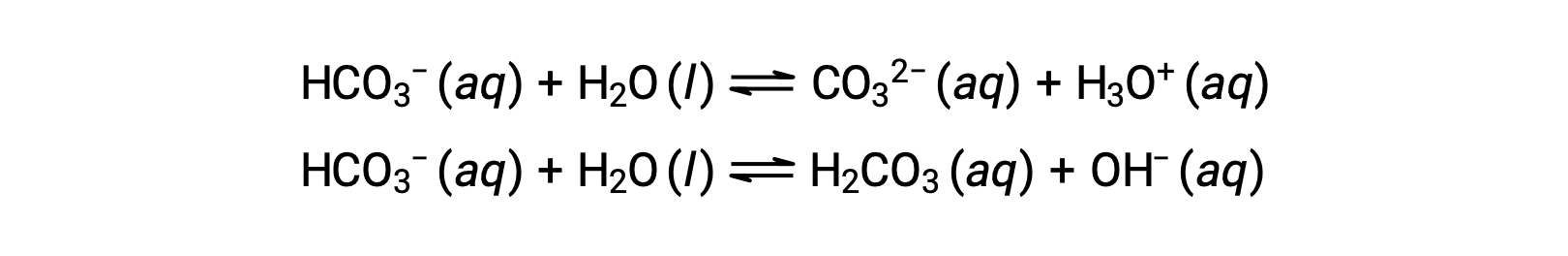
La première équation représente la réaction du bicarbonate en tant qu'acide avec de l'eau comme base, tandis que la seconde représente la réaction du bicarbonate en tant que base avec de l'eau comme acide. Lorsque du bicarbonate est ajouté à l'eau, ces équilibres sont établis simultanément et la composition de la solution obtenue peut être déterminée par des calculs d'équilibre appropriés. À l'état liquide, les molécules d'une substance amphiprotique peuvent réagir les unes avec les autres, comme illustré pour l'eau dans les équations ci-dessous :
Le processus dans lequel des molécules semblables réagissent pour donner des ions est appelé auto-ionisation. L'eau liquide subit une auto-ionisation de façon très légère ; à 25 °C, environ deux molécules d'eau sur un milliard sont ionisées. L'ampleur du processus d'auto-ionisation de l'eau se reflète dans la valeur de sa constante d'équilibre, la constante du produit ionique pour l'eau, KE :
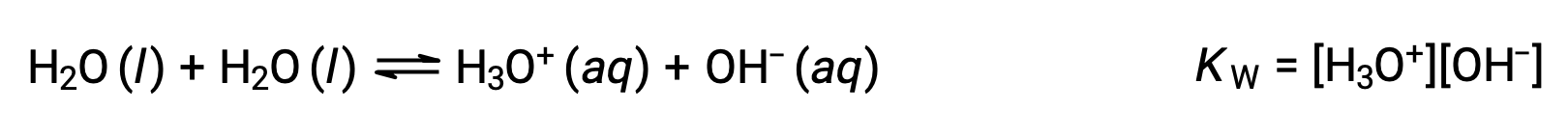
La légère ionisation de l'eau pure se reflète dans la faible valeur de la constante d'équilibre ; à 25 °C, KE a une valeur de 1,0 × 10−14.
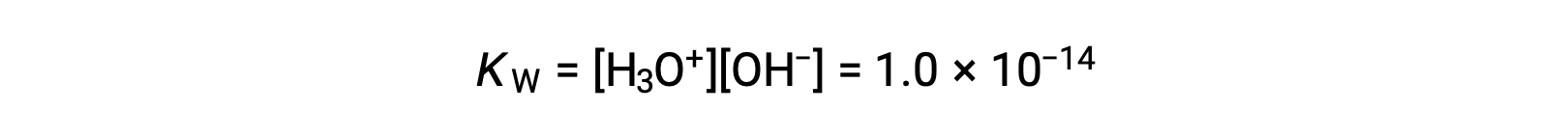
Le processus est endothermique, et donc l'importance de l'ionisation et les concentrations résultantes d'ion hydronium et d'ion hydroxyde augmentent avec la température. Par exemple, à 100 °C, la valeur de KE est d'environ 5,6 × 10−13, soit environ 50 fois plus que la valeur de 25 °C.
L'auto-ionisation de l'eau donne le même nombre d'ions hydronium et hydroxyde. Par conséquent, dans l'eau pure à 25 °C :
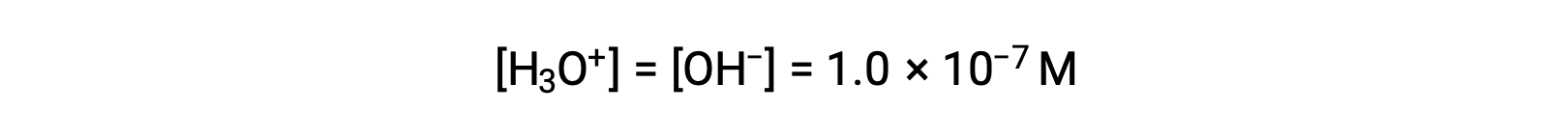
Les concentrations de ces ions dans une solution sont souvent des déterminants critiques des propriétés de la solution et des comportements chimiques de ses autres solutés, et un vocabulaire spécifique a été développé pour décrire ces concentrations en termes relatifs. Une solution est neutre si elle contient des concentrations égales d'ions hydronium et hydroxyde ; acide si elle contient une plus grande concentration d'ions hydronium que d'ions hydroxyde ; et basique si elle contient une concentration moindre d'ions hydronium que d'ions hydroxyde.
Résumé des relations pour les solutions acides, basiques et neutres
| Classification | Concentrations ioniques relatives | pH à 25 °C |
| acide | [H3O+] > [OH−] | pH < 7 |
| neutre | [H3O+] = [OH−] | pH = 7 |
| basique | [H3O+] < [OH−] | pH > 7 |
Ce texte est adapté de Openstax, Chimie 2e, Section 14.1 : Acides et bases de Brønsted-Lowry, et Section 14.2 : pH et pOH.


