15.8: 弱碱溶液
当溶解与水分子发生化学反应时,一些化合物会产生氢氧化物离子。 在所有情况下,这些化合物只会部分反应,因此被归类为弱碱。 这些类型的化合物的性质也很丰富,各种技术中的重要商品也很丰富。 例如,弱碱氨的全球生产量通常每年超过 100 公吨,被广泛用作农用化肥,用于其他化合物化学合成的原材料以及家用清洁剂中的活性成分。 当溶解在水中时,氨对产率氢氧化物离子有部分反应,如下所示:
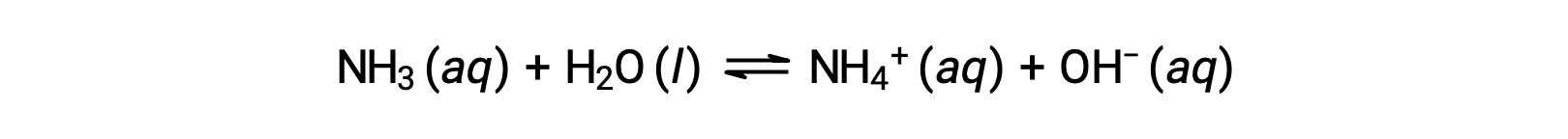
根据定义,这是一种 酸-碱 反应,在这种情况下,将H+ 离子从水分子转移到氨分子。 在典型情况下,只有大约 1% 的溶解氨被显示为 NH4+ 离子。
计算氢氧化物离子浓度和弱碱中的 pOH 溶液
查找氢氧化物浓度, pOH 和三甲胺 0.25 M 溶液的 pH 值 (弱碱) :
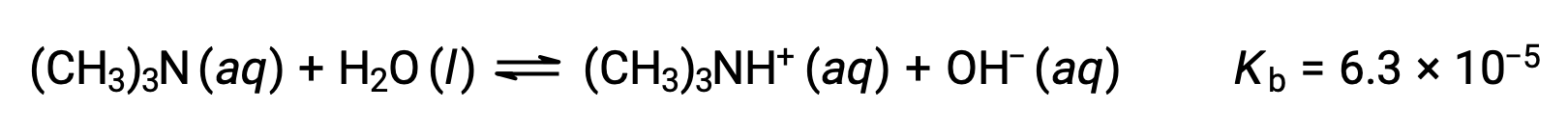
此系统的 ICE表格 是
| (CH3)3N (aq) | (CH3)3NH+ (aq) | OH− (aq) | |
| 初始浓度 (M) | 0.25 | 0 | ~0 |
| 变化 (M) | −x | +x | +x |
| 平衡浓度 (M) | 0.25 − x | 0 + x | ~0 + x |
平衡浓度项代入 Kb 表达式给出
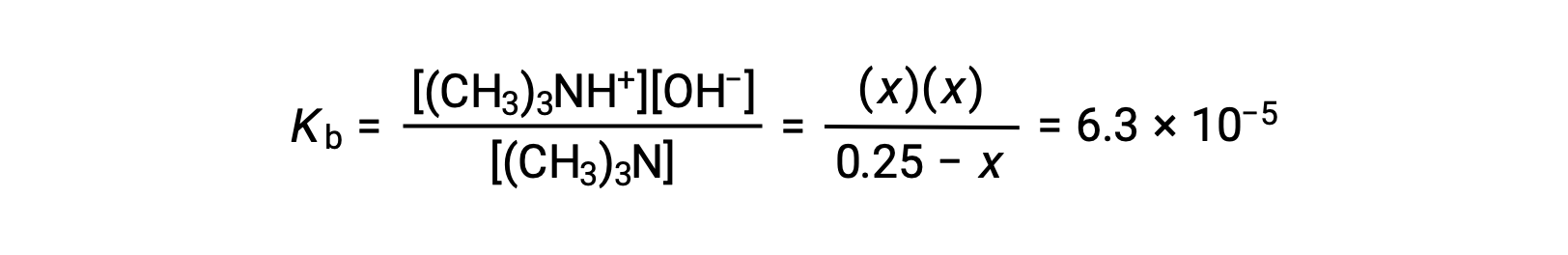
假设x << 0.25 并解 x 得出
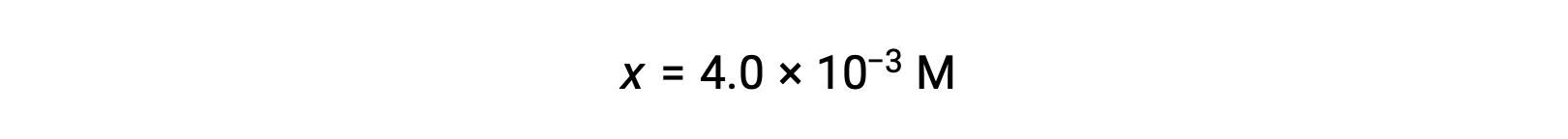
该值小于初始浓度 (0.25) 的 5% ,因此假设是合理的。
按照 ICE表格 中的定义,x 等于氢氧化物离子的平衡浓度:
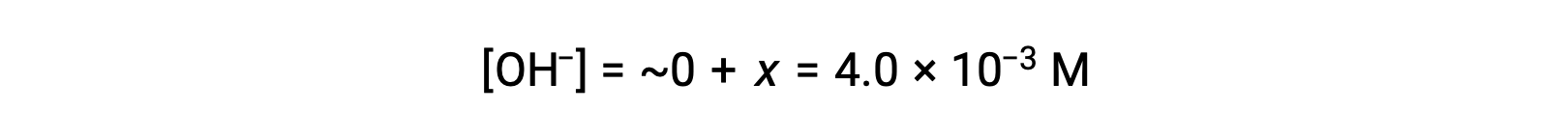
计算 pOH 为
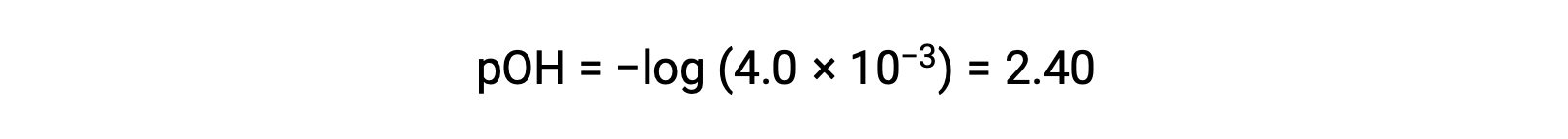
使用关系;
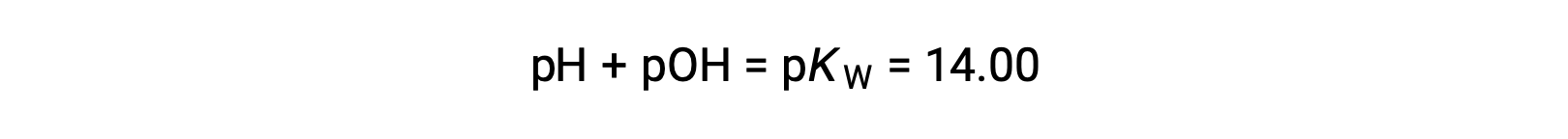
允许计算 pH 值:
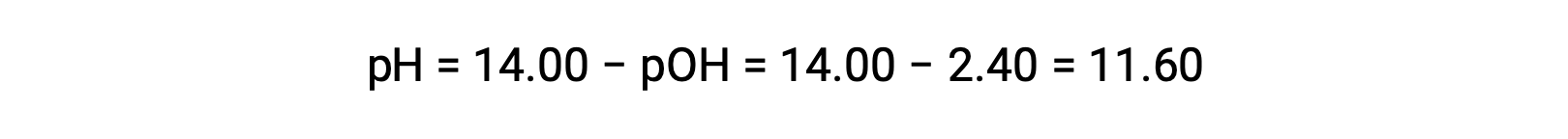
通过 pH 值测定 Kb
如果乙胺(C2H5NH2) 的0.28 M 溶液的pH值为12.10, 其 Kb 是什么?
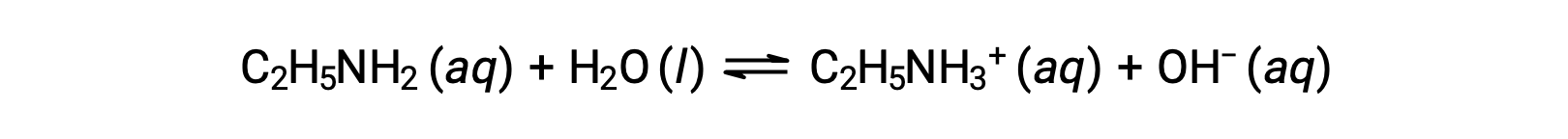
要计算乙胺的 Kb ,首先需要确定 pOH 氢氧化物离子浓度。由于 pH 值为 12.10,pOH 的计算方法如下:
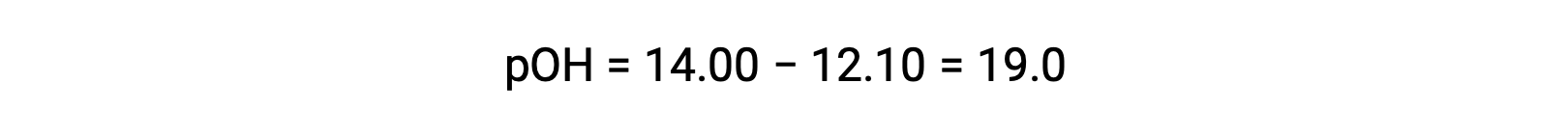
由于pOH 为 1.90, 因此可以使用公式计算溶液的氢氧化物离子浓度
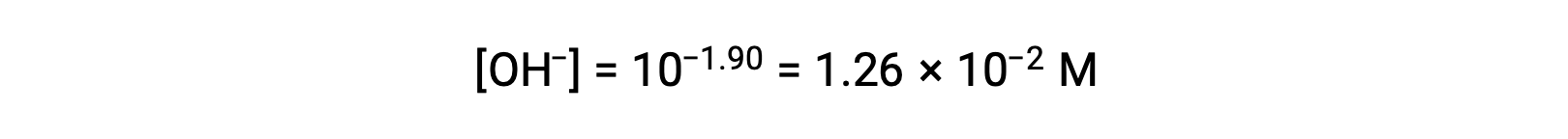
此系统的 ICE 表格可如下构建
| C2H5NH2 (aq) | C2H5NH3+ (aq) | OH− (aq) | |
| 初始浓度 (M) | 0.28 | 0 | ~0 |
| 变化(M) | −0.0126 | +0.0126 | +0.0126 |
| 平衡浓度 (M) | 0.28 − 0.0126 | 0.0126 | 0.0126 |
由于 0.0126 M 为0.28 M 的4.5%, 按 5% 规则,0.28 − 0.0126 可被视为几乎等于 0.28 M。
在将以上值代入表达式乙胺的Kb 后,
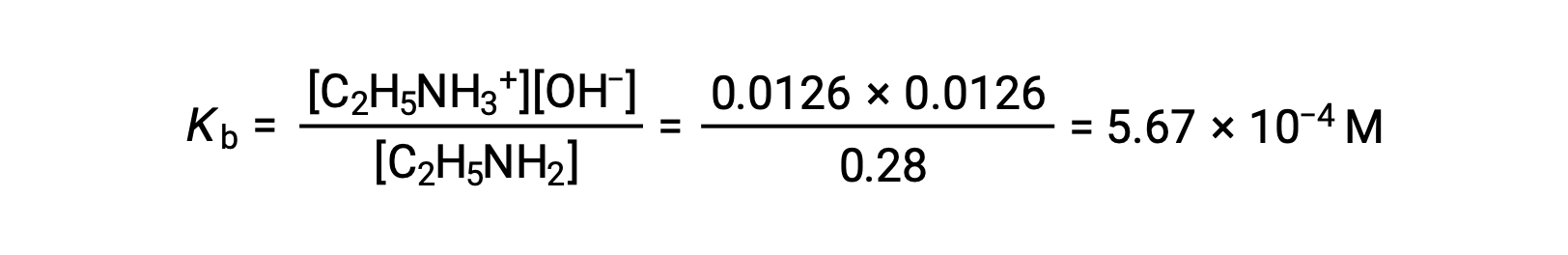
由于 0.0126 M 为 0.28 M 的 4.5% ,按照 5% 规则, 0.28 − 0.0126 可被视为几乎等于 0.28 M。
用表达式中的上述值替换乙胺的 KB 后,
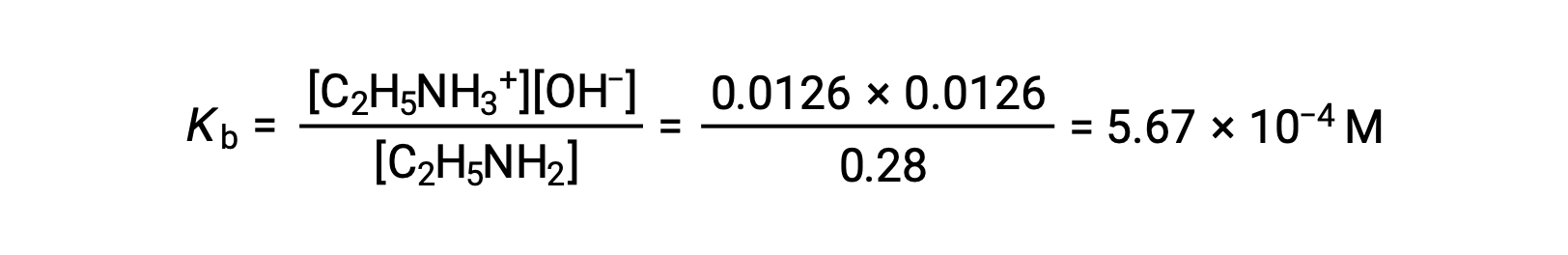
本文改编自 Openstax, 化学 2e 第 4.2 节:化学反应分类 和 14.3 酸和碱的相对强度。


