15.10: Iões como Ácidos e Bases
Sais com Iões Acídicos
Os sais são compostos iónicos compostos por catiões e aniões, podendo estes ser submetidos a uma reação de ionização ácida ou báscia com água. As soluções aquosas de sais, por conseguinte, podem ser ácidas, básicas, ou neutras, dependendo das forças relativas de ácido-base dos iões constituintes do sal. Por exemplo, a dissolução do cloreto de amónio em água resulta na sua dissociação, como descrito pela equação:
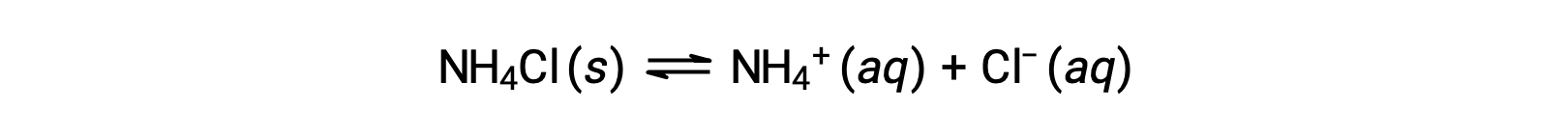
O ião amónio é o ácido conjugado da base amoníaco, NH3; a sua reação de ionização ácida (ou hidrólise ácida) é representada por
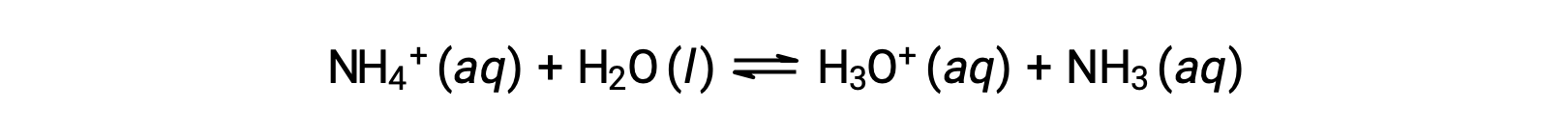
Como o amoníaco é uma base fraca, Kb é mensurável e Ka > 0 (o ião amónio é um ácido fraco).
O ião cloreto é a base conjugada do ácido clorídrico e, por conseguinte, a sua reação de ionização básica (ou hidrólise básica) é representada por
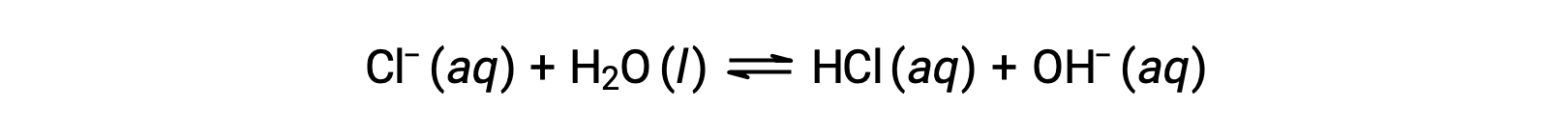
Como o HCl é um ácido forte, Ka é imensamente grande e Kb ≈ 0 (os iões cloreto não são submetidos a hidrólise apreciável). Assim, a dissolução do cloreto de amónio na água produz uma solução de catiões ácidos fracos (NH4+) e aniões inertes (Cl−), resultando em uma solução ácida.
Sais com Iões Básicos
Como outro exemplo, considere a dissolução de acetato de sódio em água:
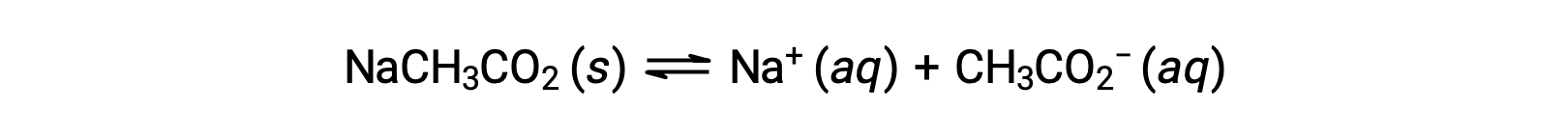
O ião de sódio não é submetido a uma ionização ácida ou básica apreciável e não tem qualquer efeito sobre o pH da solução. Isto pode parecer óbvio a partir da fórmula do ião, que indica que não há átomos de hidrogénio ou oxigénio, mas alguns iões metálicos dissolvidos funcionam como ácidos fracos, conforme referido mais adiante nesta secção. O ião acetato, CH3CO2−, é a base conjugada do ácido acético, CH3CO2H, e portanto a sua reação de ionização básica (ou hidrólise básica) é representada por
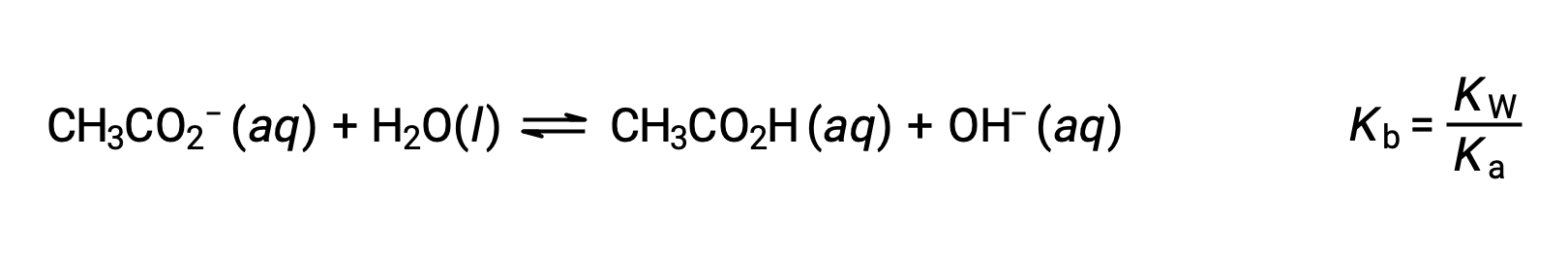
Como o ácido acético é um ácido fraco, a sua Ka é mensurável e Kb > 0 (o ião acetato é uma base fraca). A dissolução do acetato de sódio em água produz uma solução de catiões inertes (Na+) e aniões básicos fracos (CH3CO2−), resultando em uma solução básica.
Sais com Iões Acídicos e Básicos
Alguns sais são compostos por iões acídicos e básicos, e portanto o pH das suas soluções dependerá das forças relativas destas duas espécies. Para esses tipos de sais, uma comparação dos valores de Ka e Kb permite a previsão do estado ácido ou básico da solução.
A Ionização de Iões Metálicos Hidratados
Ao contrário dos iões metálicos dos grupos 1 e 2 dos exemplos anteriores (Na+, Ca2+, etc.), alguns iões metálicos funcionam como ácidos em soluções aquosas. Estes iões não são apenas vagamente solvatados por moléculas de água quando dissolvidos; em vez disso, são ligados covalentemente a um número fixo de moléculas de água para produzir um ião complexo (ver o capítulo sobre química de coordenação). Como um exemplo, a dissolução do nitrato de alumínio em água é tipicamente representada como

No entanto, o ião de alumínio(III) reage com seis moléculas de água para formar um ião complexo estável, e assim a representação mais explícita do processo de dissolução é
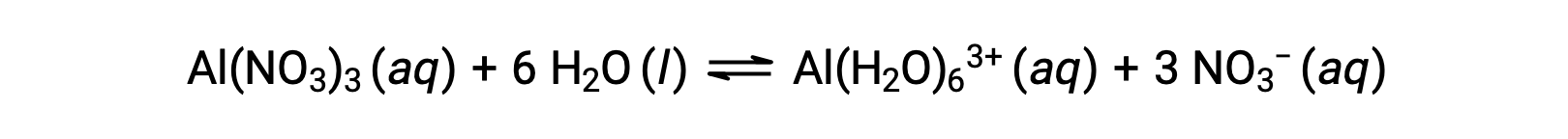
Os iões Al(H2O)63+ envolvem ligações entre um átomo central de Al e os átomos de O das seis moléculas de água. Consequentemente, as ligações O–H das moléculas de água ligadas são mais polares do que em moléculas de água não ligadas, tornando as moléculas ligadas mais propensas a doarem um ião de hidrogénio:
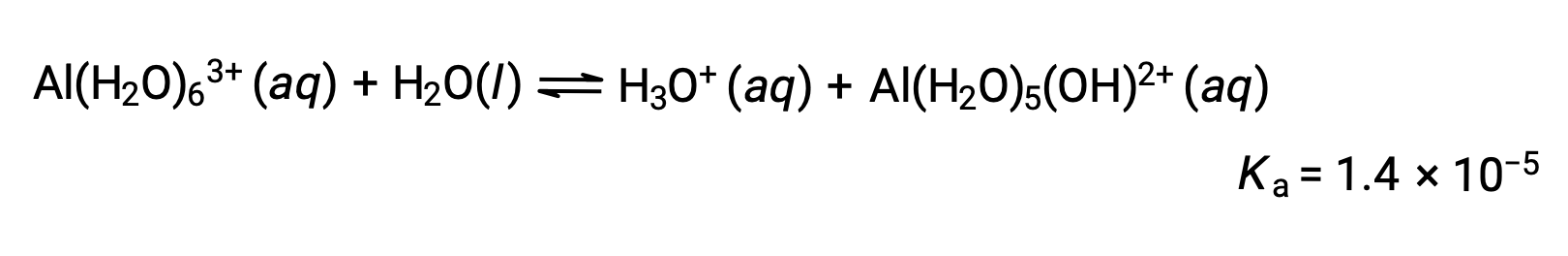
A base conjugada produzida por este processo contém cinco outras moléculas de água ligadas capazes de agir como ácidos, pelo que a transferência sequencial ou gradual de protões é possível, conforme ilustrado em algumas equações abaixo:
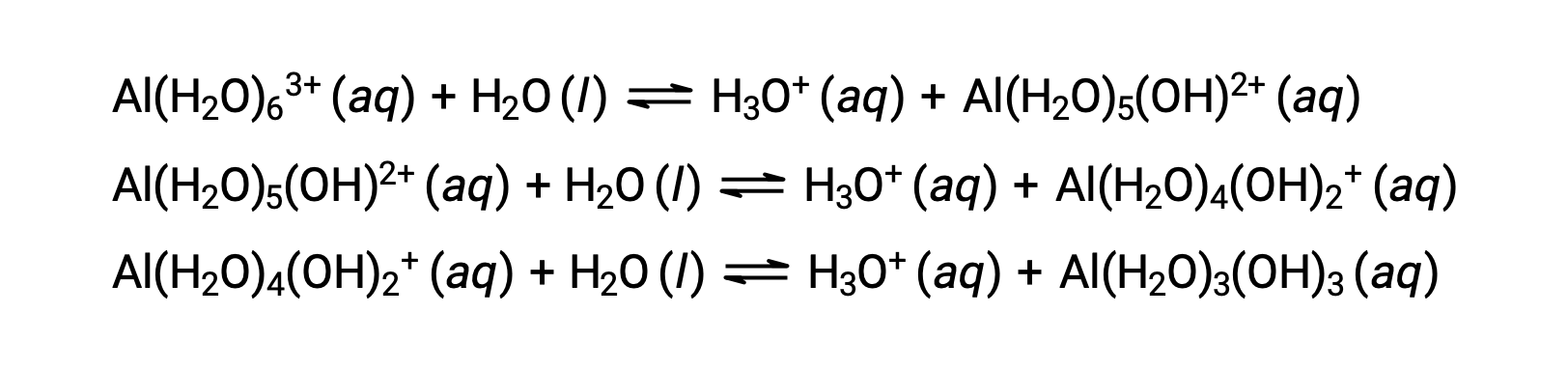
Sem contar com os metais alcalinos (grupo 1) e de alguns metais alcalinoterrosos (grupo 2), a maioria dos outros iões metálicos serão submetidos a ionização ácida, em certa medida, quando dissolvidos em água. A resistência ácida destes iões complexos aumenta normalmente com o aumento da carga e a diminuição do tamanho dos iões metálicos. As equações de ionização ácida do primeiro passo para alguns outros iões metálicos ácidos são apresentadas abaixo:
| Equações de Ionização de Primeiro Passo | pKa |
| Fe(H2O)63+ (aq) + H2O (l) ⇌ H3O+ (aq) + Fe(H2O)5(OH)2+ (aq) | 2,74 |
| Cu(H2O)62+ (aq) + H2O (l) ⇌ H3O+ (aq) + Cu(H2O)5(OH)+ (aq) | ~6,3 |
| Zn(H2O)42+ (aq) + H2O (l) ⇌ H3O+ (aq) + Zn(H2O)3(OH)+ (aq) | 9,6 |
Este texto é adaptado de Openstax, Chemistry 2e, Section 14.4: Hydrolysis of Salts.


