15.12: Polyacides
Les acides sont classés selon le nombre de protons par molécule qu'ils peuvent céder dans une réaction. Les acides tels que HCl, HNO3 et HCN qui contiennent un atome d'hydrogène ionisable dans chaque molécule sont appelés des acides monoprotiques. Leurs réactions avec l'eau sont :
| Acides monoprotiques : réactions avec l'eau |
| HCl (aq) + H2O (l) ⟶ H3O+ (aq) + Cl− (aq) |
| HNO3 (aq) + H2O (l) ⟶ H3O+ (aq) + NO3− (aq) |
| HCN (aq) + H2O (l) ⇌ H3O+ (aq) + CN− (aq) |
Même s'il contient quatre atomes d'hydrogène, l'acide acétique CH3CO2H est également un acide monoprotique car seul l'atome d'hydrogène du groupe carboxyle (COOH) réagit avec les bases :
De même, les bases monoprotiques sont des bases qui acceptent un seul proton.
Les acides diprotiques contiennent deux atomes d'hydrogène ionisables par molécule ; l'ionisation de ces acides se produit en deux étapes. La première ionisation a toujours lieu dans une plus grande mesure que la seconde ionisation. Par exemple, l'acide sulfurique, un acide fort, s'ionise comme suit :
| Acide diprotique : acide sulfurique (H2SO4) | ||
| 1re ionisation | H2SO4 (aq) + H2O (l) ⇌ H3O+ (aq) + HSO4− (aq) | Ka1 = plus de 102 ; dissociation totale |
| 2nde ionisation | HSO4− (aq) + H2O (l) ⇌ H3O+ (aq) + SO42− (aq) | Ka2 = 1,2 × 10−2 |
Ce processus d'ionisation par étapes se produit pour tous les acides polyprotiques. L'acide carbonique, H2CO3, est un exemple d’acide diprotique faible. La première ionisation de l'acide carbonique produit des ions hydronium et des ions bicarbonate en petites quantités.
Première ionisation : H2CO3 (aq) + H2O (l) ⇌ H3O+ (aq) + HCO3− (aq)
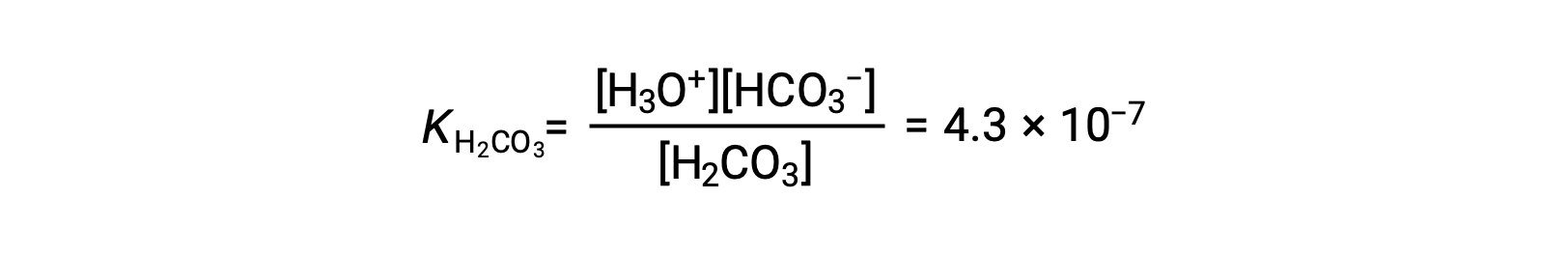
L'ion bicarbonate peut également agir comme un acide. Il s'ionise et forme des ions hydronium et des ions carbonate en quantités encore plus petites.
Seconde ionisation : HCO3− (aq) + H2O (l) ⇌ H3O+ (aq) + CO32− (aq)
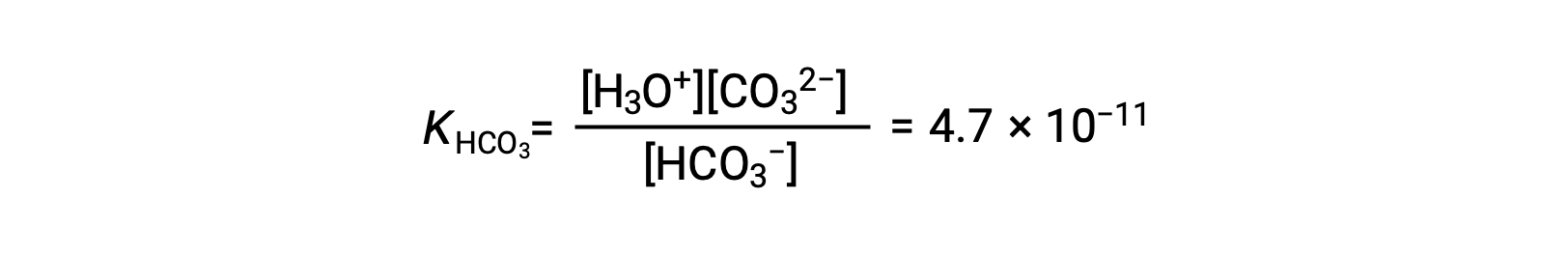
KH2CO3 est plus grand que KHCO3− par un facteur de 104, donc H2CO3 est le principal producteur d'ion hydronium dans la solution. Cela signifie que peu de HCO3− formé par l'ionisation de H2CO3 s'ionise pour donner des ions hydronium (et des ions carbonate), et les concentrations de H3O+ et HCO3− sont pratiquement égales dans une solution aqueuse pure de H2CO3.
Si la première constante d'ionisation d'un acide diprotique faible est plus grande que la seconde par un facteur d'au moins 20, il convient de traiter la première ionisation séparément et de calculer les concentrations qui en résultent avant de calculer les concentrations d'espèces qui résultent de l'ionisation suivante. Cette approche est démontrée dans l'exemple suivant.
Ionisation d'un acide diprotique
“ L'eau gazeuse ” contient une quantité convenable de dioxyde de carbone dissous. La solution est acide parce que le CO2 réagit avec l'eau pour former de l'acide carbonique, H2CO3. Que sont [H3O+], [HCO3−] et [CO32−] dans une solution saturée de CO2 avec une [H2CO3] initiale = 0,033 ?
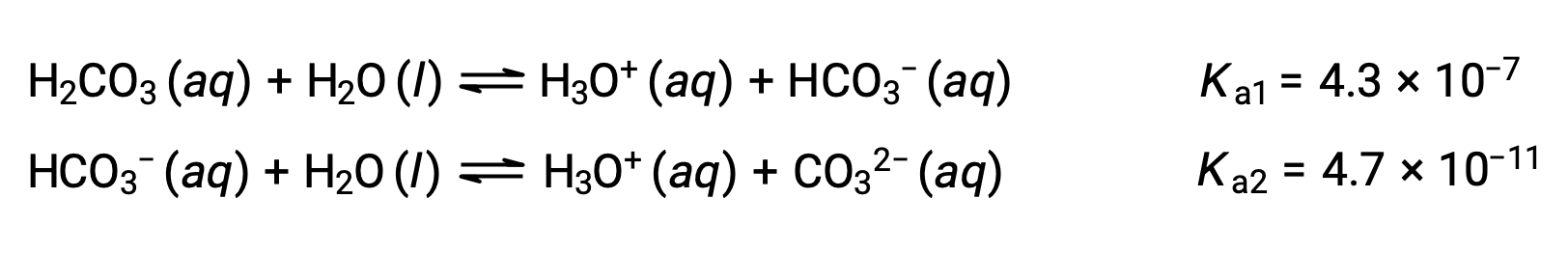
Comme l'indiquent les constantes d'ionisation, H2CO3 est un acide beaucoup plus fort que HCO3−, de sorte que les réactions d'ionisation par étapes peuvent être traitées séparément. À l'aide des informations fournies, on prépare un tableau ICE pour cette première étape d'ionisation :
| H2CO3 (aq) | H3O+ (aq) | HCO3− (aq) | |
| Concentration initiale (M) | 0,033 | ~0 | 0 |
| Changement (M) | −x | +x | +x |
| Concentration à l'équilibre (M) | 0,033 − x | x | x |
Le remplacement des concentrations à l'équilibre dans l'équation de l'équilibre donne
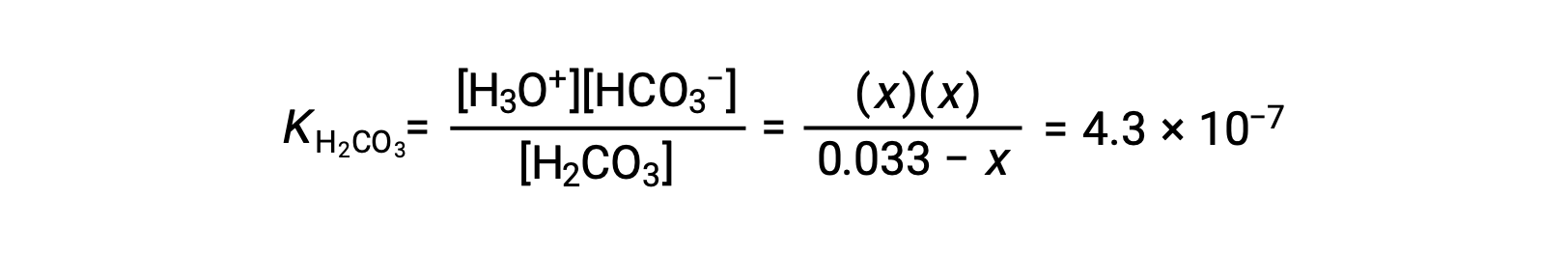
En supposant que x << 0,033 et en résolvant l'équation simplifiée donne
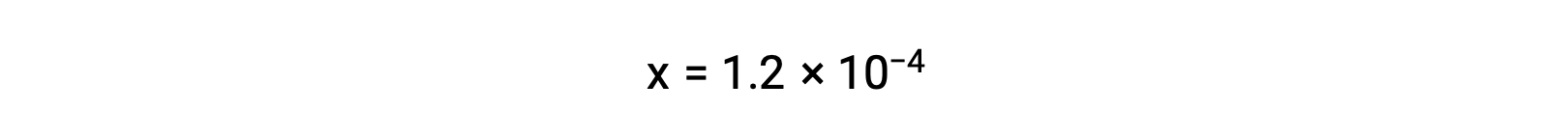
Le tableau ICE définit x comme étant égal à la molarité de l'ion bicarbonate et à la molarité de l'ion hydronium :
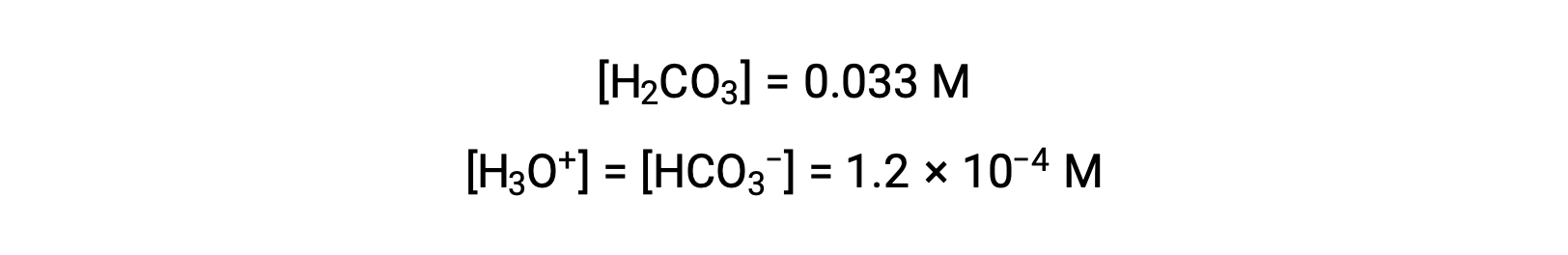
En utilisant la concentration en ions bicarbonate calculée ci-dessus, la seconde ionisation est soumise à un calcul d'équilibre semblable : HCO3− (aq) + H2O (l) ⇌ H3O+ (aq) + CO32− (aq)
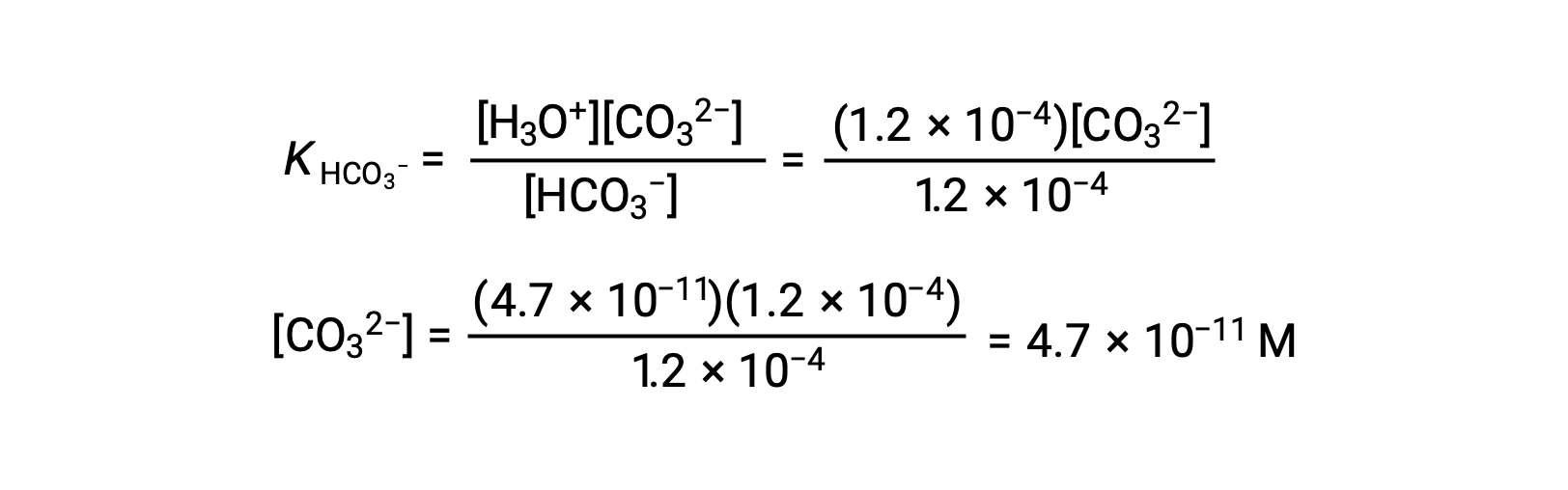
En résumé : à l'équilibre [H2CO3] = 0,033 M ; [H3O+] = 1,2 × 10−4 ; [HCO3−] = 1,2 × 10−4 M ; et [CO32−] = 4,7 × 10−11 M.
Un acide triprotique est un acide qui possède trois atomes H ionisables. L'acide phosphorique en est un exemple :
| Acide triprotique : acide phosphorique (H3PO4) | ||
| 1re ionisation | H3PO4 (aq) + H2O (l) ⇌ H3O+ (aq) + H2PO4− (aq) | Ka1 = 7,5 × 10−3 |
| 2e ionisation | H2PO4− (aq) + H2O (l) ⇌ H3O+ (aq) + HPO42− (aq) | Ka2 = 6,2 × 10−8 |
| 3e ionisation | HPO42− (aq) + H2O (l) ⇌ H3O+ (aq) + PO43− (aq) | Ka3 = 4,2 × 10−13 |
Comme pour les exemples d’acides diprotiques, chaque réaction d'ionisation successive est moins étendue que la première, ce qui se reflète dans les valeurs décroissantes des constantes d'ionisation acide progressives. Il s'agit d'une caractéristique générale des acides polyprotiques et les constantes d'ionisation successives diffèrent souvent par un facteur d'environ 105 à 106.
Cet ensemble de trois réactions de dissociation peut sembler compliquer les calculs des concentrations à l'équilibre dans une solution de H3PO4. Cependant, comme les constantes d'ionisation successives diffèrent d'un facteur allant de 105 à 106, il existe de grandes différences dans les petits changements de concentration qui accompagnent les réactions d'ionisation. Cela permet d'utiliser des suppositions et des processus de simplification mathématique, comme le montrent les exemples ci-dessus. Les bases polyprotiques sont capables d'accepter plus d'un ion hydrogène. L'ion carbonate est un exemple de base diprotique, car il peut accepter deux protons, comme illustré ci-dessous. Comme dans le cas des acides polyprotiques, notez que les constantes d'ionisation diminuent avec l'étape d'ionisation. De même, les calculs d'équilibre impliquant des bases polyprotiques suivent les mêmes approches que ceux des acides polyprotiques.
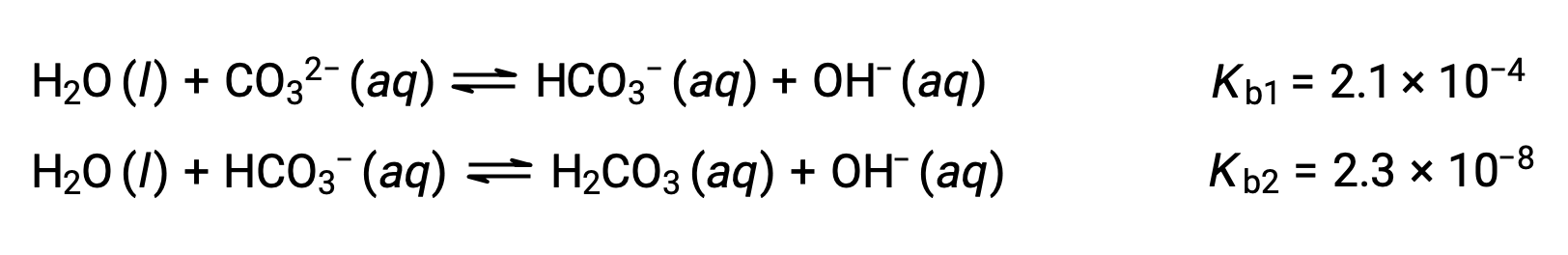
Ce texte est adapté de Openstax, Chimie 2e, Section 14.5: Acides polyprotiques.


