16.3: Уравнение Хендерсона-Хассельбаха
Выражение ионизационной константы для раствор слабой кислоты можно записать как:
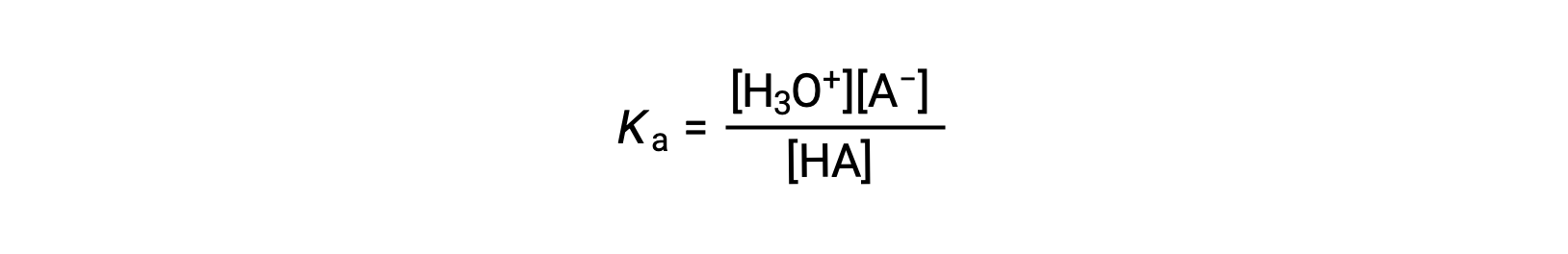
Изменение порядка решения для получения [H3O+] ресурса:
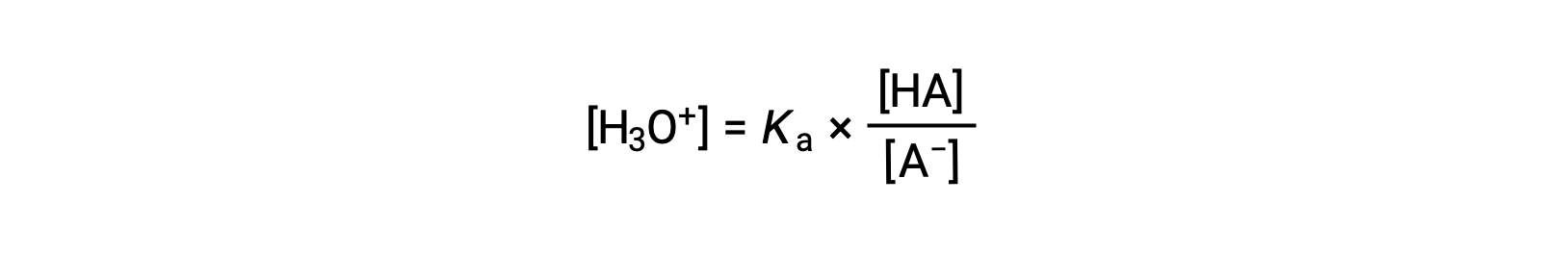
Принимая отрицательный логарифм обеих сторон этого уравнения, дает
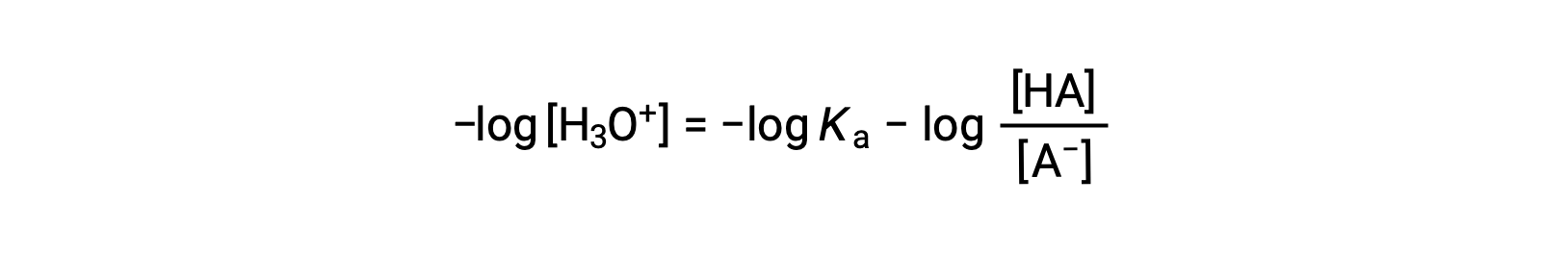
которые могут быть написаны как
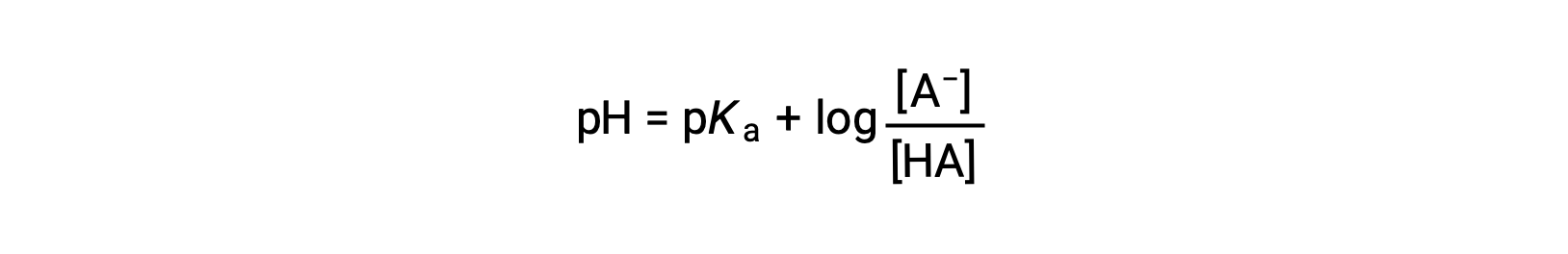
Где pKa — отрицательный логарифм константы ионизации слабой кислоты (pKa = -Log Ka). Это уравнение связывает pH, константу ионизации слабой кислоты и концентрации слабой пары сопряженных кислотно-основная в буферизованном раствор. Ученые часто используют это выражение, называемое уравнением Хендерсон-Хасселбалч, для расчета pH буферных растворов. Важно отметить, что для использования этого уравнения должно быть допустимо предположение “x is small”.
Лоуренс Джозеф Хендерсон и Карл Альберт Хасселбалч
Лоуренс Джозеф Хендерсон (1878–1942) был американским врачом, биохимиком и физиологом, чтобы назвать лишь несколько его многочисленных занятий. Он получил медицинскую степень в Гарварде, а затем 2 лет учился в Страсбурге, затем в Германии, после чего вернулся на должность лектора в Гарварде. В конце концов он стал профессором Гарварда и всю свою жизнь работал там. Он обнаружил, что баланс кислотно-основная в крови человека регулируется буферной системой, образованной растворенным в крови диоксидом углерода. В 1908 году он написал уравнение для описания карбонатно-кислотной буферной системы в крови. Хендерсон был широко осведомлен; помимо важных исследований по физиологии крови, он также писал о адаптациях организмов и их соответствии их среде, социологии и университетскому образованию. Он также основал лабораторию усталости в Гарвардской школе бизнеса, которая изучала физиологию человека с особым упором на работу в промышленности, упражнении и питании.
В 1916 году Карл Альберт Хасселбалч (1874–1962), датский врач и химик, поделился авторством в статье с Кристианом Бохром в 1904 году, в которой описали эффект Бора, это показало, что способность гемоглобина крови связываться с кислородом обратно была обратно связана с кислотностью крови и концентрацией углекислого газа. Шкала рН была введена в 1909 году другим датчанем, Сёренсеном, а в 1912 году Хасселбалхом опубликовал измерения рН крови. В 1916 году Хасселбалч выразил уравнение Хендерсона в логарифмических терминах, согласующихся с логарифмической шкалой pH, и, таким образом, родилось уравнение Хендерсона-Хасселбалча.
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 14.6: Буферы.


