16.4: Calcul des changements de pH dans une solution tampon
Un tampon peut empêcher une chute ou une augmentation soudaine du pH d'une solution après l'ajout d'un acide fort ou d'une base forte jusqu'à son pouvoir tampon ; toutefois, l'ajout d'un acide fort ou d'une base forte entraîne un léger changement du pH de la solution. Le petit changement de pH peut être calculé en déterminant la variation de la concentration des constituants du tampon qui en résulte, c'est-à-dire un acide faible et sa base conjuguée ou vice versa. Les concentrations obtenues à l’aide de ces calculs stœchiométriques peuvent être utilisées pour déterminer le pH final de la solution à l’aide de l’équation de Henderson-Hasselbalch ou d’un tableau ICE.
Par exemple, une solution tamponnée contient 0,65 mol d'acide formique et de formiate de sodium. Comme la concentration de l’acide faible et de sa base conjuguée est la même ici, le pH de la solution est égal au pKa de l’acide faible, qui est de 3,74 dans ce cas. Si 0,05 mol de HNO3 est ajouté à cette solution, les variations de la concentration de l'acide formique et du formiate de sodium qui s'ensuivent peuvent être déterminées par des calculs stœchiométriques comme indiqué dans le tableau ci-dessous.
| H+ (aq) | HCOO− (aq) | HCOOH (aq) | |
| Avant ajout (M) | ~0,00 mol | 0,65 mol | 0,65 mol |
| Ajout (M) | 0,050 mol | - | - |
| Après ajout (M) | ~0,00 mol | 0,60 mol | 0,70 mol |
Le pH final de la solution peut ensuite être déterminé en insérant les concentrations modifiées d’acide formique et de formiate de sodium dans l’équation de Henderson-Hasselbalch.
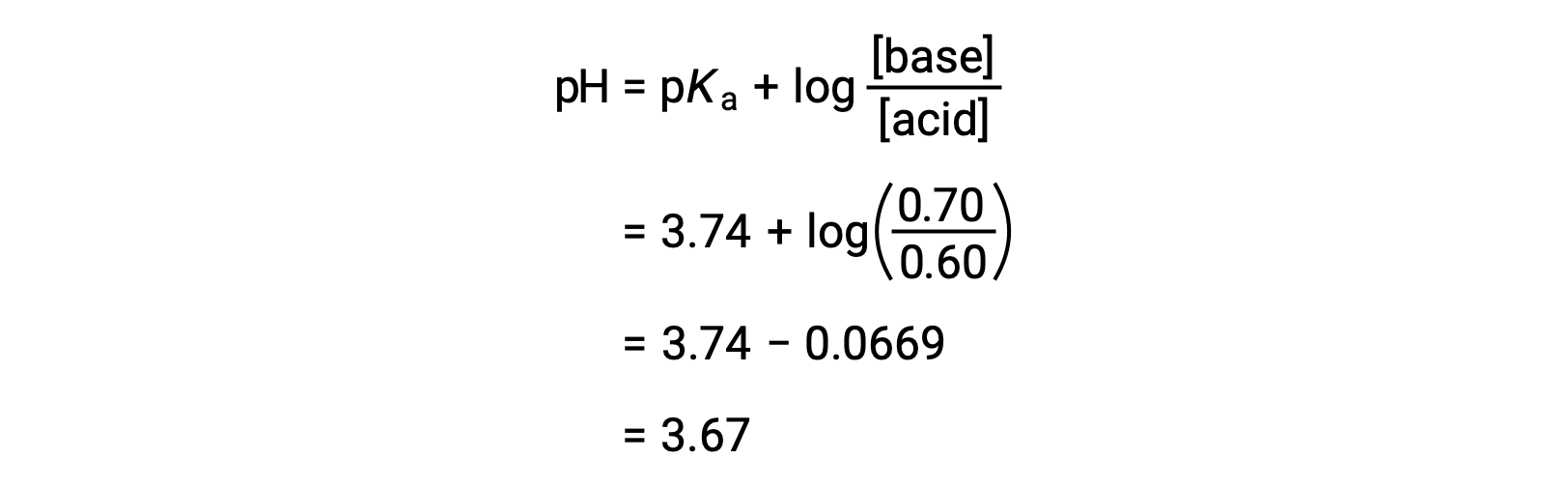
Ainsi, l'addition de 0,05 mol de HNO3 réduit le pH de la solution de 3,74 à 3,67.
De même, si 0,10 mol de NaOH est ajouté dans la même solution, les variations de la concentration de l'acide formique et du formiate de sodium qui s'ensuivent peuvent être déterminées par des calculs stœchiométriques comme indiqué dans le tableau ci-dessous.
| OH− (aq) | HCOOH (aq) | HCOO− (aq) | H2O (l) | |
| Avant ajout (M) | ~0,00 mol | 0,65 mol | 0,65 mol | -&¬#173; |
| Ajout (M) | 0,10 mol | - | - | ¬- |
| Après ajout (M) | ~0,00 mol | 0,55 mol | 0,75 mol | ¬- |
On peut ensuite déterminer le pH final de la solution en insérant les concentrations modifiées d'acide formique et de formiate de sodium dans l'équation de Henderson-Hasselbalch.
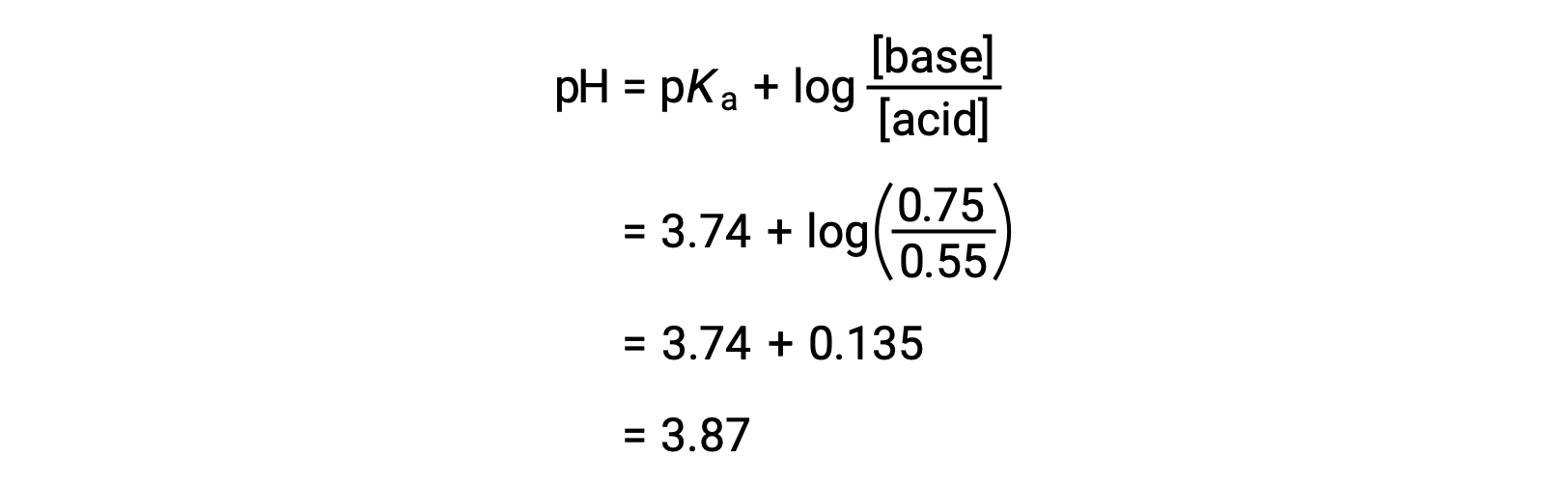
Ainsi, l'addition de 0,10 mol de NaOH augmente le pH de la solution de 3,74 à 3,87.


