16.8: 滴定計算:弱酸-弱塩基
滴定溶液のpH計算: 弱酸および強塩基
25.00 mLの0.100 M CH3CO2Hを0.100 M NaOHで滴定する場合、反応は次のように表すことができます。
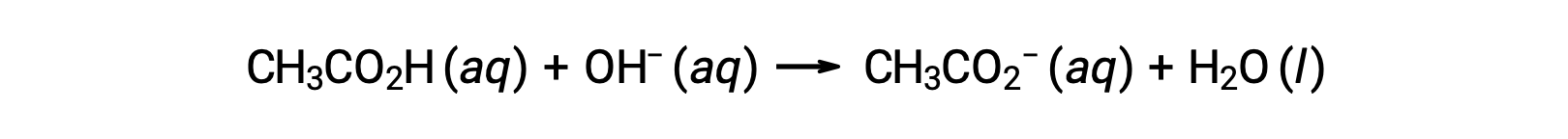
異なる容量のNaOH滴定液を添加した後の滴定液のpHは、以下のように計算できます。
(a) 酢酸溶液の初期pHは、通常のICE法で計算されます。
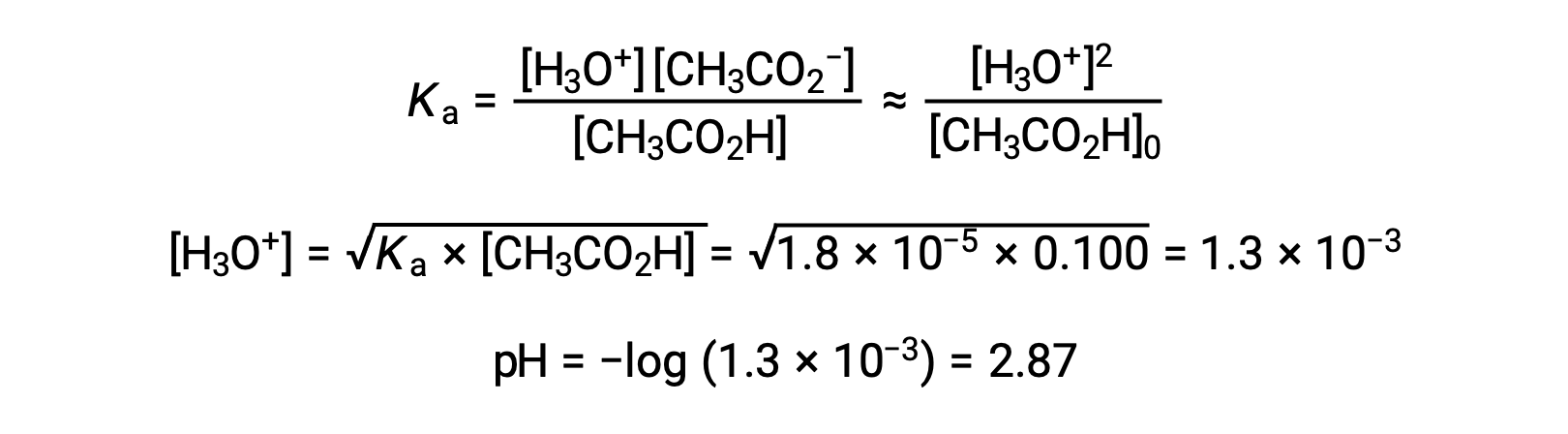
(b) 酸と滴定試薬はともに単分子から構成され、試料と滴定試薬は等濃度であるため、この滴定試薬の量が当量点を表します。強酸性の例とは異なり、この場合の反応混合物には弱い共役塩基(酢酸イオン)が含まれています。以下の濃度で存在する酢酸の塩基イオン化を考慮して、溶液のpHを計算します。
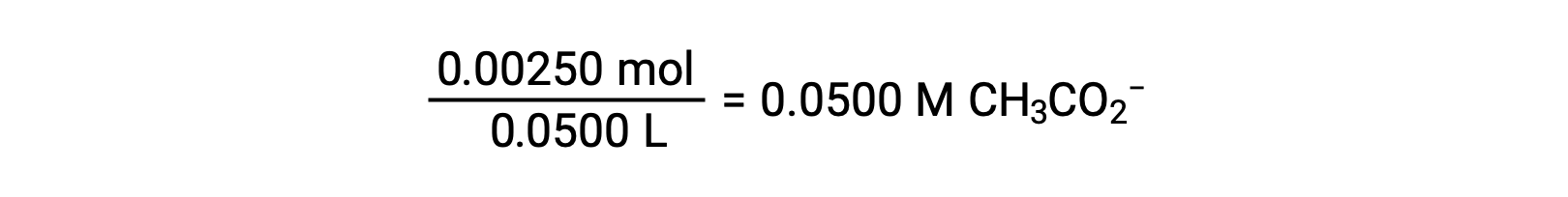
酢酸のイオン化は、次の式で表されます。
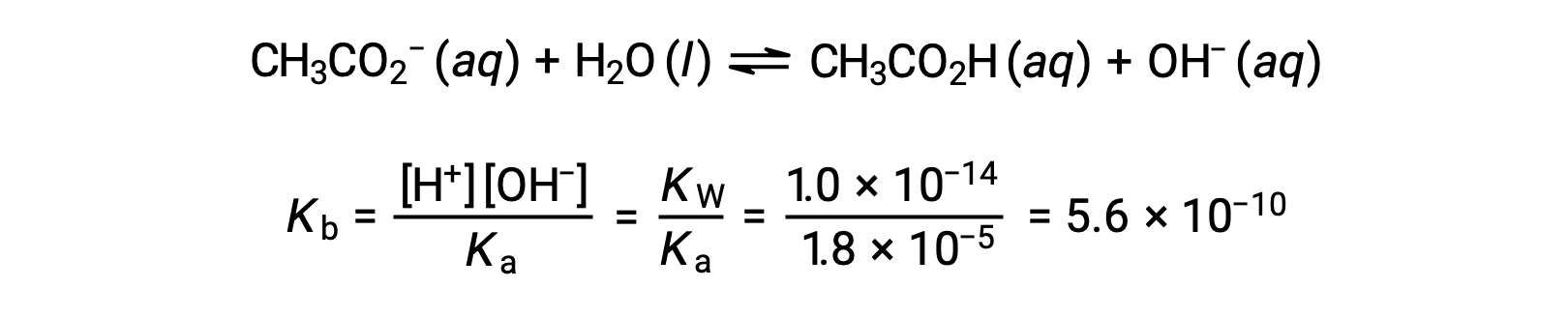
x << 0.0500とすると、pHは通常のICE法で計算できます。
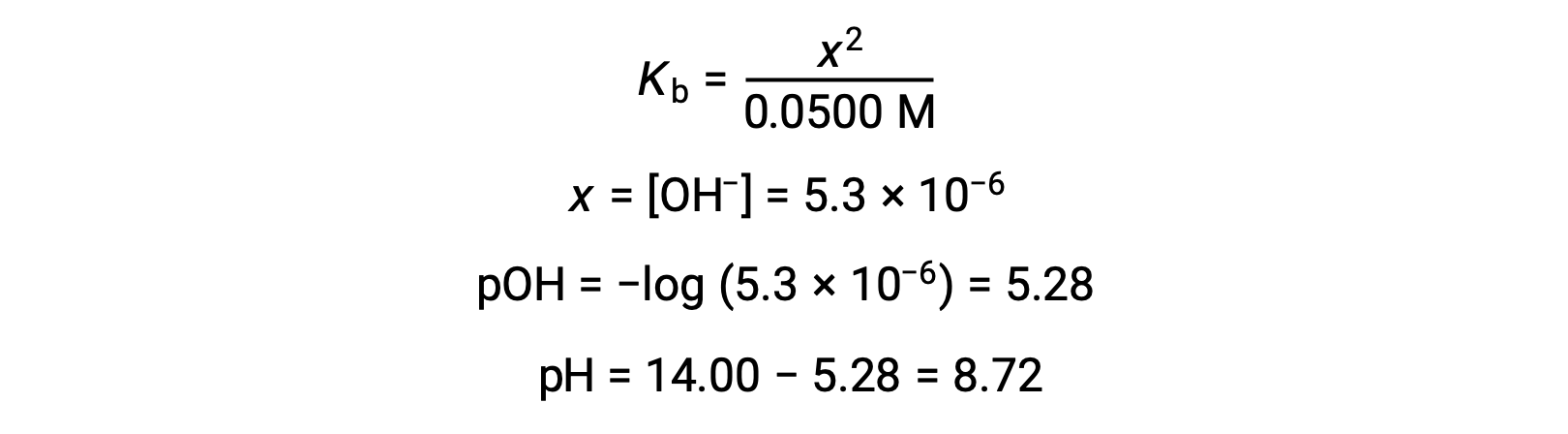
弱酸と強塩基を滴定したときに予想されるように、この滴定の当量点でのpHは7よりもかなり大きいことに注意する必要があります。
(c) 滴定溶液 = 12.50 mLの場合。この量は、化学量論的な滴定液量の2分の1に相当し、2分の1の酢酸が中和されて、同量の酢酸イオンが生成します。すなわち、酸と共役塩基の濃度は等しいです。この場合、ヘンダーソン・ハッセルバルヒ式を用いてpHを計算するのが便利です。
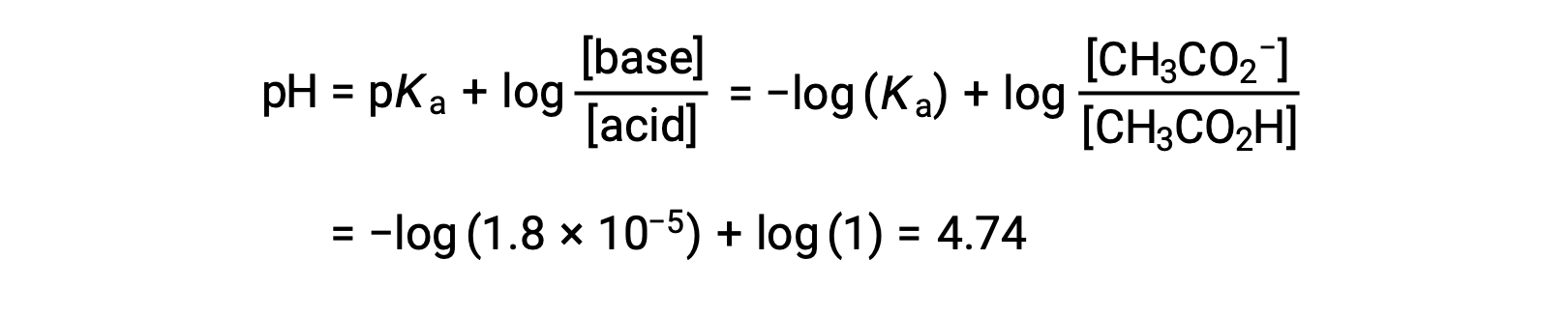
(pH = 弱酸性の滴定における半当量点でのpKa)
(d) 滴定液量 = 37.50 mLの場合。この量は化学量論的に過剰であり、生成物である酢酸イオンと過剰量の滴定試薬の両方を含む反応溶液となります。このような溶液では、溶液のpHは主に過剰量の強塩基により決まります。

上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 14.7: Acid-base Titrations.


