16.8: Cálculos de Titulación: Ácido Débil - Base Débil
Cálculo del pH para soluciones de titulación: Ácido débil/base fuerte
Para la titulación de 25,00 ml de CH3CO2 0,100 M con NaOH 0,100 M, la reacción puede representarse como:
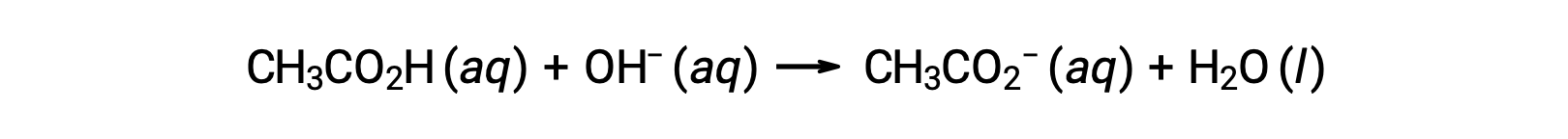
El pH de la solución de titulación tras la adición de los diferentes volúmenes de NaOH tititulante puede calcularse de la siguiente manera:
(a) Se calcula el pH inicial de la solución de ácido acético con el método ICE habitual:
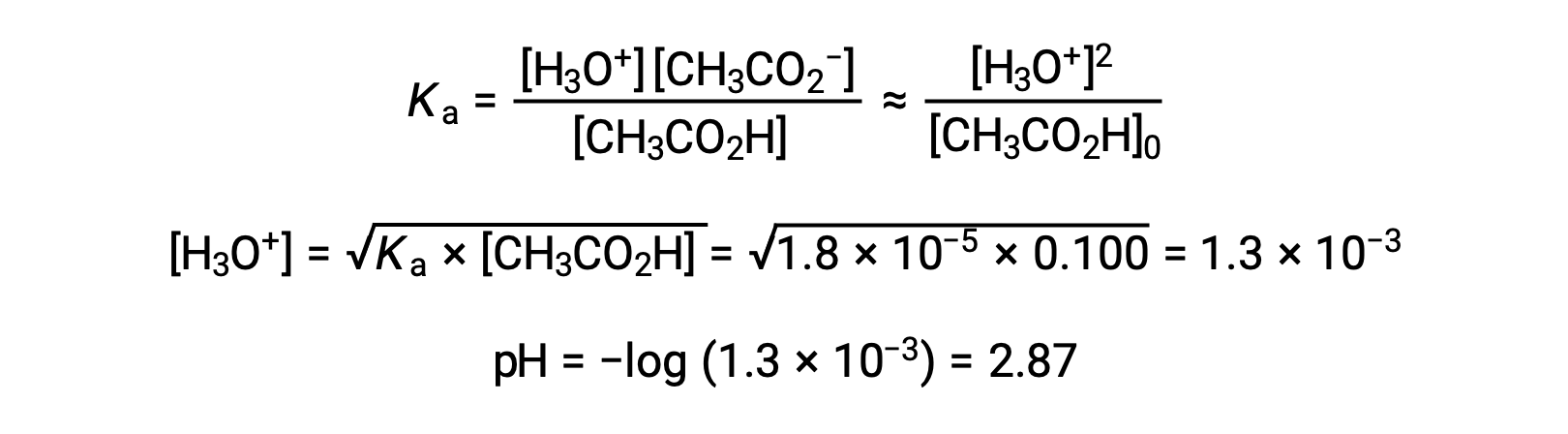
(b) el ácido y el titulante son monopróticos y las soluciones de muestra y de titulación tienen la misma concentración; por lo tanto, este volumen de titulante representa el punto de equivalencia. A diferencia del ejemplo del ácido fuerte, la mezcla de reacción en este caso contiene una base conjugada débil (ion acetato). El pH de la solución se calcula teniendo en cuenta la ionización básica del acetato, que está presente a una concentración de
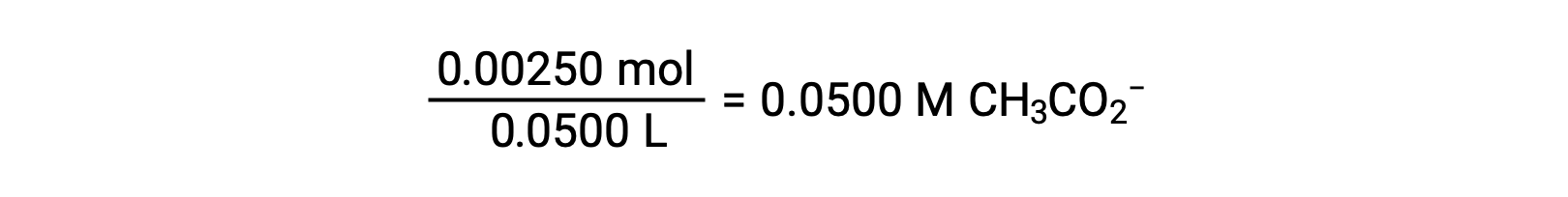
La ionización básica del acetato se representa mediante la ecuación
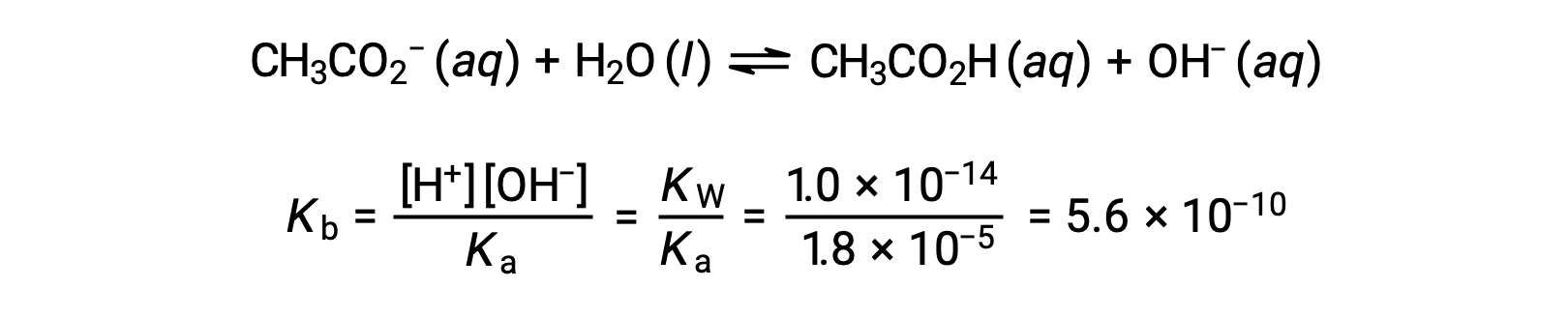
Suponiendo x << 0,0500, el pH puede calcularse mediante el método ICE habitual:
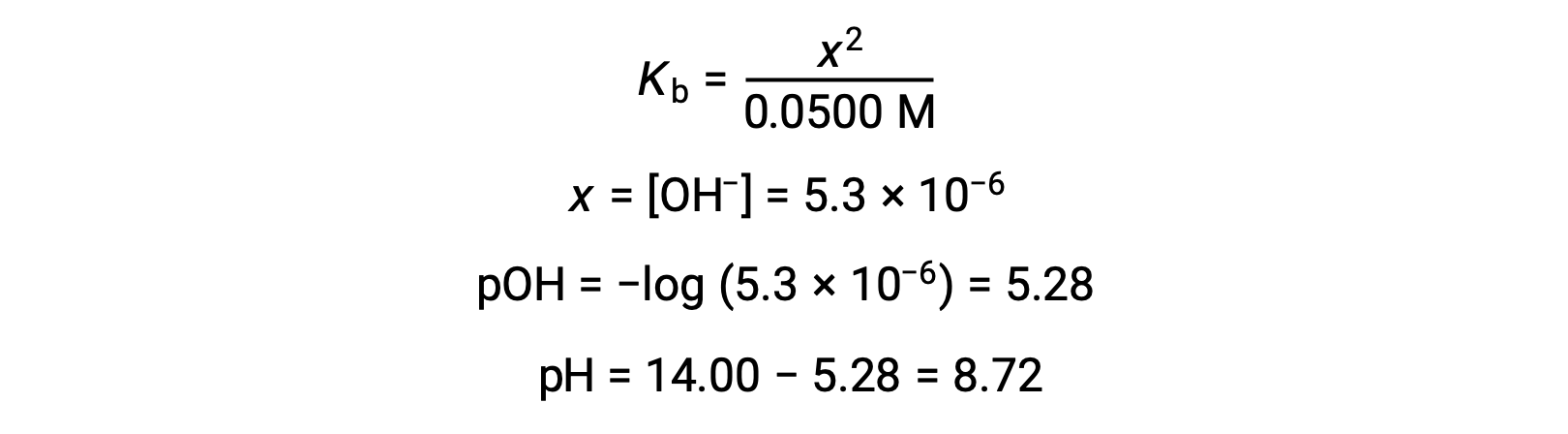
Tenga en cuenta que el pH en el punto de equivalencia de esta titulación es significativamente mayor que 7, como se espera al titular un ácido débil con una base fuerte.
(c) Volumen de titulante = 12,50 ml. Este volumen representa la mitad de la cantidad estequiométrica de la solución titulante, por lo que la mitad del ácido acético se ha neutralizado para producir una cantidad equivalente de ion acetato. Por lo tanto, las concentraciones de estos pares conjugados ácido-base son iguales. Un enfoque conveniente para calcular el pH es el uso de la ecuación de Henderson-Hasselbalch:
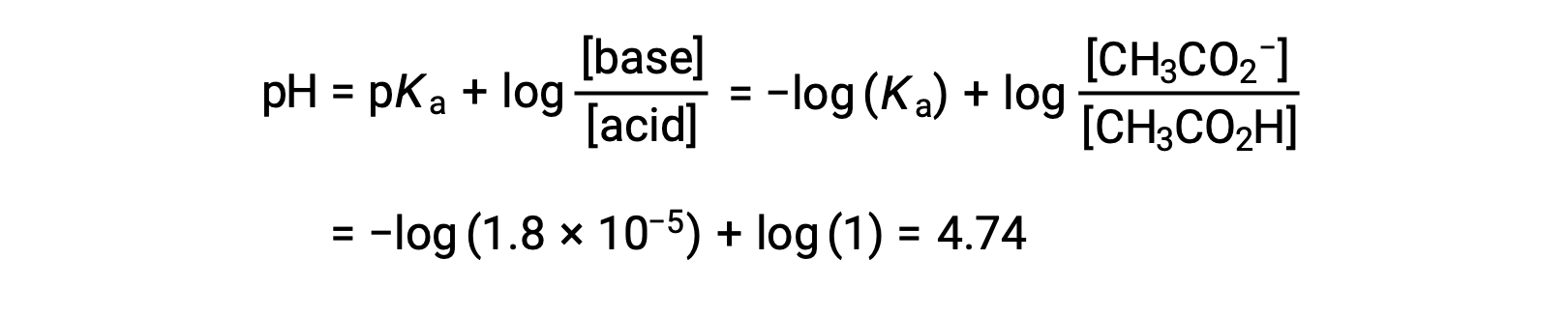
(pH = pKa en el punto de semiequivalencia en una titulación de un ácido débil)
(d) Volumen de titulación = 37,50 ml. Este volumen representa un exceso estequiométrico de titulante y una solución de reacción que contiene tanto el producto de titulación como el ion acetato y el exceso de titulante fuerte. En tales soluciones, el pH de la solución es determinado principalmente por el exceso de base fuerte:

Este texto es adaptado de Openstax, Química 2e, Sección 14.7: Titulaciones ácido-base.


